
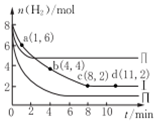
 一定温度下向体积为2L的恒容密闭容器中充入6molCO2和8mo1H2,发生反应:CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49KJ•mol-1.测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( )
一定温度下向体积为2L的恒容密闭容器中充入6molCO2和8mo1H2,发生反应:CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49KJ•mol-1.测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( )| A. | 该反应在O~8min内的v(CO2)=0.125mol•L-1•min-1 | |
| B. | 若起始时向容器中充入3mo1CO2和4molH2,则平衡时CH3OH的体积分数大于20% | |
| C. | 若起始时向容器中充入4mo1CO2和2molH2、2molCH3OH、1molH2O(g),则此时反应v(正)>v(逆) | |
| D. | 曲线II、曲线III改变条件分别是升高温度、减小压强 |
分析 A.根据v=$\frac{△c}{△t}$计算v(H2),再利用速率之比等于其化学计量数之比计算v(CO2);
B.由图可知,I平衡时氢气为2mol,利用三段式计算平衡时各组分物质的量,进而计算甲醇体积分数.若起始时向上述容器中充入3 mol CO2和4 mol H2,等效为原平衡压强减小一倍,平衡向逆反应方向移动,甲醇的体积分数减小;
C.根据B中计算可知平衡时二氧化碳、氢气、甲醇、水的浓度,代入平衡常数表达式K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$计算平衡常数,再计算此时的浓度商Qc,与平衡常数比较,判断反应进行方向;
D.与Ⅰ相比,Ⅱ到达平衡时间短,且平衡时氢气浓度大,说明改变条件反应速率加快、反应向逆反应方向移动;与I相比,Ⅲ到达平衡时间短,且平衡时氢气浓度小,说明改变条件反应速率加快、反应向正反应方向移动.
解答 解:A.由图可知,0~8 min内H2的物质的量变化量为8mol-2mol=6mol,故v(H2)=$\frac{\frac{6Mmol}{2L}}{8min}$=0.375 mol•L-1•min-1,速率之比等于其化学计量数之比,故v(CO2)=$\frac{1}{3}$v(H2)=0.125 mol•L-1•min-1,故A正确;
B.由图可知,I平衡时氢气为2mol,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol):6 8 0 0
转化(mol):2 6 2 2
平衡(mol):4 2 2 2
故I中平衡时甲醇体积分数为$\frac{2mol}{4mol+2mol+2mol+2mol}$=20%,若起始时向上述容器中充入3 mol CO2和4 mol H2,等效为原平衡压强减小一倍,平衡向逆反应方向移动,甲醇的体积分数减小,即平衡时H2的体积分数小于20%,故B错误;
C.平衡常数K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{1×1}{2×{1}^{3}}$=0.5,此时的浓度商Qc=$\frac{\frac{2}{2}×\frac{1}{2}}{\frac{4}{2}×(\frac{2}{2})^{3}}$=0.25<K=0.5,故平衡向正反应方向移动,v(正)>v(逆),故C正确;
D.与Ⅰ相比,Ⅱ到达平衡时间短,且平衡时氢气浓度大,说明改变条件反应速率加快、反应向逆反应方向移动,若升高温度,反应速率加快,正反应为放热反应,平衡向逆反应方向移动,符合题意;与I相比,Ⅲ到达平衡时间短,且平衡时氢气浓度小,说明改变条件反应速率加快、反应向正反应方向移动,若减小压强,平衡逆向进行氢气的物质的量应增大,不符合题意,故D错误;
故选AC.
点评 本题考查物质的量随时间变化曲线、反应速率影响因素及计算、化学平衡影响因素与计算、平衡常数应用等,侧重考查学生分析计算能力,C中注意利用平衡常数判断反应进行方向,难度中等.


科目:高中化学 来源: 题型:解答题
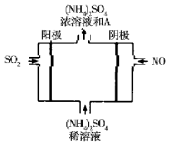 近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:
近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 物质 温度/℃ | 活性炭 | NO | CO2 | N2 |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中可提取镁,电解熔融氯化镁可制得金属镁 | |
| B. | 研制高性能的耐磨轮胎,可减少PM2.5等细颗粒物的产生 | |
| C. | 玛瑙、水晶、钻石、红宝石等装饰品的主要成分都是硅酸盐 | |
| D. | 开发二氧化碳制成的全降解塑料,缓解日益严重的“白色污染” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$→_{高温}^{H_{2}O}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| B. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$Ag(NH3)2OH(aq)$→_{水浴加热}^{麦芽糖}$Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | K37ClO3与浓盐酸在加热条件下生成氯气:37ClO3-+6Cl-+6H+═37Cl-+3Cl2↑+3H2O | |
| D. | 4mol•L-1的NaAlO2溶液与7mol•L-1的盐酸等体积互相均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
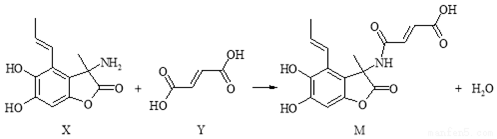
| A. | X分子中有2个手性碳原子 | |
| B. | Y分子中所有原子一定不可能在同一平面内 | |
| C. | 可用FeCl3溶液或NaHCO3溶液鉴别X和Y | |
| D. | 在NaOH溶液中,1 mol M最多可与5 mol NaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
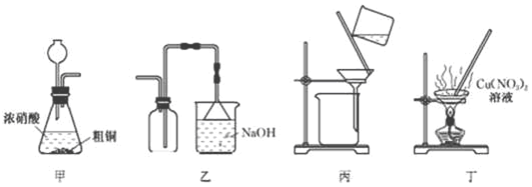
| A. | 用装置中制备NO2 | B. | 用装置乙收集NO2 | ||
| C. | 用装置丙过滤除去固体杂质 | D. | 装置丁蒸发至干得纯净硝酸铜晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①② | C. | ②③⑤ | D. | ②④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com