
A过滤法;B结晶法;C分液法;D萃取分液法;E蒸馏法;F升华法
(l)除去食盐水中的泥沙_________________(2)除去植物油中的水_________________
(3)将溶液中的硝酸钾与氯化钠分离____________(4)将自来水制为纯净水________________
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中3个碳原子在同一直线上 | |
| B. | 分子中所有原子都在同一平面上 | |
| C. | 分子中共价键的夹角为120° | |
| D. | 分子中共价键数为8,其中有一个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
绿色植物是空气天然的“净化器”,研究发现,10000m2柳杉每月可以吸收160kgSO2,则100 m2柳杉每月吸收的SO2的物质的量为
A.2.5mol B.5mol C.25mol D.250mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:填空题
生态农业涉及农家肥料的综合利用。某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体8.96L(标准状况)。该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO 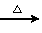 CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L0.lmol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。求:
CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L0.lmol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。求:
(1)原混合气体中甲烷的体积(标准状况)(写出计算过程)
(2)反应后的气体中CO2的物质的量可能为___________
(3)原混合气体中氮气的体积为__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
有一在空气中暴露过的NaOH固体,经分析知其含H2O7.65%,含Na2CO3 4.32%,其余是NaOH。若将ag样品放入bmL1mol/L的盐酸,使其充分作用后,残留酸用25.52mLcmol/L的NaOH溶液恰好中和完全。则蒸发所得溶液,得到固体质量的表达式中(单位为克)
A.应含有a B.只含有b C.比含有c D.一定有a、b、c
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
下列属于电解质并能导电的物质是
A.淀粉 B.KNO3 溶液 C.FeC13 晶体 D.熔融的Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2是…. b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4探究催化剂对该反应速率的影响. | |
| 体积(mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1 次 | 第2 次 | 第3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com