
下列事实能用电化学理论解释的是()
A. 轮船水线以下的船壳上装一定数量的锌块
B. 铝片不用特殊方法保存
C. 纯锌与稀硫酸反应时,滴入少量浓H2SO4溶液后速率加快
D. 镀锌铁不如镀锡铁耐用
考点: 原电池和电解池的工作原理.
专题: 电化学专题.
分析: A、Zn比Fe活泼,Zn与Fe构成原电池,在海水中锌被腐蚀,从而保护船壳;
B、铝片因在空气中被O2氧化,使铝片表面形成一层致密的氧化物薄膜而保护内层的铝不再被氧化;
C、硫酸浓度增大,Zn与H2SO4的反应速率加快;
D、镀锌铁破损后Zn比Fe活泼,Zn被腐蚀,而镀锡铁破损后Fe比Sn活泼,铁被腐蚀.
解答: 解:A、轮船水线下的船壳装上锌块后,可保护船壳在海水中不被腐蚀,因为Zn比Fe活泼,Zn与Fe构成原电池,在海水中锌被腐蚀,从而保护船壳,发生原电池反应可用电化学知识解释,故A正确;
B、铝片因在空气中被O2氧化,使铝片表面形成一层致密的氧化物薄膜而保护内层的铝不再被氧化,所以铝片不用特殊方法保存,此现象与电化学知识无关,故B错误;
C、纯Zn和稀H2SO4反应速率慢,滴入少量浓H2SO4溶液后,硫酸浓度增大,加快Zn与H2SO4的反应速率,此现象与电化学知识无关,故C错误;
D、镀锌铁发生金属被腐蚀现象时,因Zn比Fe活泼,Zn被腐蚀,镀锡铁破损后发生电化腐蚀,因Fe比Sn活泼,因而是铁被腐蚀,所以,镀锌铁比镀锡铁耐用,发生原电池反应而可用电化学知识解释,但结论错误,故D错误;
故选A.
点评: 本题考查了化学腐蚀和电化腐蚀的实质分析,原电池的形成条件是解题关键,题目较简单.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定地方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值: (列出计算过程)
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.1,则该样品中FeCl3的物质的量分数为 。在实验室中,FeCl2可用铁粉和 反应制备,FeCl3可用铁粉和 反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 ,该电池总反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
检验某未知溶液中是否含SO42-的下列操作中,合理的是( )
A.先加硝酸酸化,再加氯化钡溶液 B.先加硝酸酸化,再加硝酸钡溶液
C.先加盐酸酸化,再加氯化钡溶液 D.先加盐酸酸化,再加硝酸钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
浓硫酸具有A.强酸性B.强氧化性C.高沸点.低挥发性D.脱水性E.吸水性等性质。以下过程主要表现了浓硫酸的哪些性质?请将答案的字母分别填入括号中。
(1)热的浓硫酸与铜片等金属反应( )
(2)用磷矿粉[主要成分Ca3(PO4)2]和硫酸反应制磷酸( )
(3)热的浓硫酸分别与木炭和硫粉等反应( )
(4)浓硫酸干燥H2.O2.Cl2.HCl和SO2等气体( )
(5)常温下可以用铁或铝的容器贮存浓硫酸( )
(6)胆矾放在盛浓硫酸的干燥器中变成白色粉末( )
(7)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑( )
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用铅蓄电池进行电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极为Pb+SO42﹣═PbSO4+2e﹣,
正极为PbO2+4H++SO42﹣+2e﹣═PbSO4+2H2O,
今若制得Cl2 0.025mol,这时电池内消耗的H2SO4的物质的量至少是()
A. 0.025 mol B. 0.050 mol C. 0.10 mol D. 0.20 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂用CaSO4、H2O、NH3、CO2制备(NH4)2SO4。其工艺流程如下:
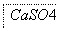
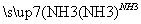

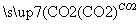

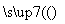
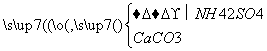
下列推断不合理的是 ( )。
A.往甲中通CO2有利于(NH4)2SO4生成
B.生成1 mol(NH4)2SO4至少消耗2 mol NH3
C.在实际生产中CO2可被循环使用
D.直接蒸干滤液能得到纯净的(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要0.1 mol·L-1NaOH溶液450 mL和
0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是____________(填仪器名称)。

(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为_________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 __0.1 mol·L-1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时未经冷却,则所得溶液浓度 0.1 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为
_______mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀盐酸,沉淀不溶解,则该溶液中( )
|
| A. | 一定有SO42﹣ | B. | 还可能有CO32﹣ |
|
| C. | 一定无Ag+ | D. | 可能有SO42﹣或Ag+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com