
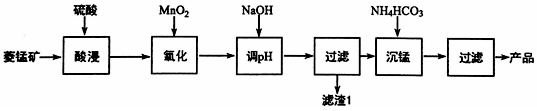
分析 菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,反应为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,过滤分离,滤液2中含有硫酸铵、硫酸钠等,据此分析作答.
解答 解:(1)增加硫酸的浓度、加热将矿石粉碎(或搅拌等)可加快酸浸的反应速率;
故答案为:将矿石粉碎(或搅拌等);
(2)在加NaOH调节溶液的pH目的是使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,若pH过大,SiO2、Al(OH)3会溶解与氢氧化钠生成硅酸钠、偏铝酸钠,导致滤渣1中Al(OH)3、SiO2减少;
故答案为:Al(OH)3、SiO2;
(3)①Mn2+被氧化为MnO4-,(NH4)2S2O8中S元素还原为SO42-,离子方程式为:2Mn2++5S2O82-+8H2O$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+;
故答案为:2Mn2++5S2O82-+8H2O$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+;
②由Mn元素守恒、电子转移守恒,可得关系式:Mn2+~MnO4-~5Fe2+,则n(Mn2+)=$\frac{1}{5}$n(Fe2+),所以c(Mn2+)=$\frac{\frac{1}{5}×V×1{0}^{-3}L×bmol/L}{a×1{0}^{-3}L}$=$\frac{bV}{5a}$mol/L;
故答案为:$\frac{bV}{5a}$mol•L-1;
(4)①滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,反应为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
②在其他条件相同时,c(NH4HCO3)越大,c(CO32-)越大,使平衡MnCO3(s)?CO32-(aq)+Mn2+(aq)向逆反应方向移动,析出的MnCO3越多,则锰元素回收率越高;
故答案为:c(NH4HCO3)越大,c(CO32-)越大,使平衡MnCO3(s)?CO32-(aq)+Mn2+(aq)向逆反应方向移动,析出的MnCO3越多,则锰元素回收率越高.
点评 本题考查物质制备工艺流程,涉及混合物的分离和提纯、氧化还原反应滴定、信息获取与迁移运用等,侧重考查学生对知识的综合运用能力,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 3a+b-c | B. | c-3a-b | C. | a-b-c | D. | c-a-b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
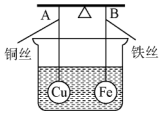 如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )| A. | 杠杆为导体和绝缘体时,均为A端高B端低 | |
| B. | 杠杆为导体和绝缘体时,均为A端低B端高 | |
| C. | 当标杆为绝缘体时,A端低B端高;为导体时,A端高B端低 | |
| D. | 当标杆为绝缘体时,A端高B端低;为导体时,A端低B端高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y 为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图,对此装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为 Zn 和碳棒,则 X 为碳棒,Y 为 Zn | |
| C. | 若两电极都是金属,则它们的活动性为 X>Y | |
| D. | X 极上发生的是还原反应,Y 极上发生的是氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2 | B. | Q1<Q2 | C. | Q1=Q2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
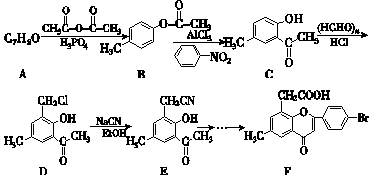
 +2NaOH→
+2NaOH→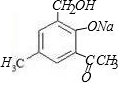 +H2O+NaCl.
+H2O+NaCl.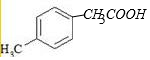 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数是89 | B. | 质子数与中子数之差为50 | ||
| C. | 核外电子数是39 | D. | ${\;}_{39}^{89}$Y与${\;}_{39}^{90}$Y互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 4种pH相同的溶液:①CH3COONa ②C6H5ONa ③NaHCO3 ④NaOH,各溶液的物质的量浓度由大到小的顺序是③>②>①>④ | |
| C. | 0.1 mol•L-1HA(某酸)的pH=3,0.1 mol•L-1 BOH(某碱)的pH=13,则BA(盐)溶液的pH<7 | |
| D. | pH=2的盐酸与pH=l的硫酸溶液中c(H+)之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 H2 能在Cl2中燃烧生成 HCl,HCl也能在一定条件下分解为H2和Cl2. 图为H2、Cl2和HCl 三者相互转化的微观过程示意图,下列说法正确的是( )
H2 能在Cl2中燃烧生成 HCl,HCl也能在一定条件下分解为H2和Cl2. 图为H2、Cl2和HCl 三者相互转化的微观过程示意图,下列说法正确的是( )| A. | 过程 1 放热 | B. | 过程 2 吸热 | C. | 过程 3 放热 | D. | 过程 4 放热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com