
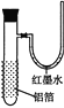
【题目】用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )
A.铝与硝酸汞反应属放热反应
B.铝是一种较活泼的金属,
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
【答案】D
【解析】
A.铝在空气中易与氧气生成氧化铝,反应物是两种生成物是一种,是化合反应,铝与硝酸汞的反应是铝能置换出硝酸汞中的汞,反应物与生成物均是一种单质一种化合物,是置换反应;属于氧化还原反应,故A正确;
B.铝的化学性质比较活泼,不久铝箔表面生出“白毛”,可知金属铝易被氧化,所以说明铝是活泼金属,故B正确;
C.红墨水柱右端上升说明试管内气压升高,可判断其温度升高,从而判断铝与氧气反应放出大量的热量;故C正确;
D.从铝的氧化以及铝与硝酸汞的反应可知铝片上生成的白毛是氧化铝,因为汞的化学性质不活泼,所以不可能是氧化汞,而是汞的单质的形式存在。所以是铝从液态汞中被氧化生成氧化铝形成的白毛,故D错误;
故答案为D。


科目:高中化学 来源: 题型:
【题目】难溶性杂卤石(K2SO4MgSO42CaSO42H2O)属于“呆矿”,在水中存在如下平衡
K2SO4MgSO42CaSO42H2O(s)2Ca2++2K++Mg2++4![]() +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
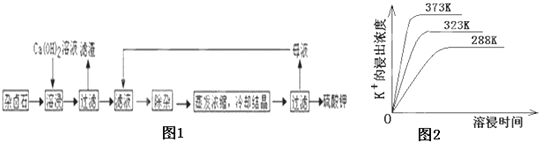
(1)滤渣主要成分有__________和___________以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________.
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入________溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①__________________________②______________________________;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+![]() CaCO3(s)+
CaCO3(s)+![]()
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K_____________(计算结果保留三位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,对可逆反应:2X(g)+Y(g)![]() Z(g)+W(s) ΔH>0的下列叙述正确的是
Z(g)+W(s) ΔH>0的下列叙述正确的是
A.加入少量W,逆反应速度增大
B.升高温度时,正反应速率增大,逆反应速率减小
C.压强不变,充入与反应体系不反应的N2,反应速率减小;体积不变,充入N2,反应速度不变
D.平衡后加入X,上述反应的ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤转化为水煤气的主要化学反应为C(s)+H2O(g)![]() CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH=-242.0 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸气反应的热化学反应方程式:______________。
(2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出如图循环图,并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
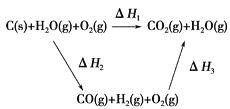
请甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是________________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是:
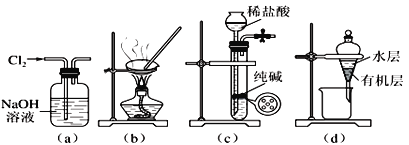
A. 用图(a)所示装置除去氯气中含有的少量氯化氢
B. 用图(b)所示装置蒸发氯化钠溶液制备氯化钠晶体
C. 用图(c)所示装置制取少量纯净的二氧化碳气体
D. 用图(d)所示装置分离苯萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能含有K+、Mg2+、Al3+、AlO2—、SiO32—、SO32—、CO32—、SO42—中的若干种离子。某同学对该溶液X进行了如下实验;下列判断正确的是( )
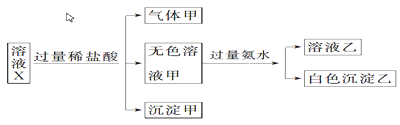
A. 气体甲一定是纯净物
B. K+、AlO2—和SiO32—一定存在于溶液X中
C. 沉淀甲是硅酸和硅酸镁的混合物
D. 凭以上实验能确定SO42—是否存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁防护方法有多种,如图中的方法描述正确的是
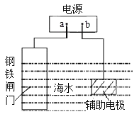
A.b为电源负极
B.该方法是牺牲阳极的阴极保护法
C.电子流向:a→钢铁闸门→辅助电极→b→a
D.电源改用导线连接进行防护时,辅助电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普鲁卡因M(结构简式为![]() )可用作临床麻醉剂,熔点约60 ℃。它的一条合成路线如下图所示(部分反应试剂和条件已省略):
)可用作临床麻醉剂,熔点约60 ℃。它的一条合成路线如下图所示(部分反应试剂和条件已省略):
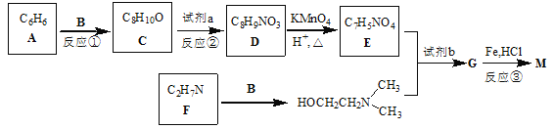
已知:B和乙醛互为同分异构体;![]() 的结构不稳定。
的结构不稳定。
完成下列填空:
(1)比A多两个碳原子,且一氯代物只有3种的A的同系物的名称是____________。
(2)写出反应①和反应③的反应类型反应①_______________,反应③_______________。
(3)写出试剂a和试剂b的名称或化学式 试剂a________________,试剂b____________________。
(4)反应②中将试剂a 缓缓滴入C中的理由是_____________________________。
(5)写出B和F的结构简式 B________________________,F________________
(6)写出一种同时满足下列条件的D的同分异构体的结构简式________________。
①能与盐酸反应 ②能与碳酸氢钠反应 ③苯环上有2种不同环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种常用的化工原料,应用十分广泛。以H2合成尿素CO(NH2)2的有关热化学方程式有:
①N2(g)+3H2(g)=2NH3(g) △H1=-92.4kJ·mol-1
②NH3(g)+![]() CO2(g)=
CO2(g)=![]() NH2CO2NH4(s) △H2=-79.7kJ·mol-1
NH2CO2NH4(s) △H2=-79.7kJ·mol-1
③NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) △H3=+72.5kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com