
分析 ①Ⅰ:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s)△H=-178.3kJ/mol
根据盖斯定律Ⅰ+Ⅱ+Ⅲ可得C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g),据此计算△H;
②该反应为气体体积不变的反应放热反应,提高H2产率必须使平衡向着正向移动,结合平衡移动原理分析.
解答 解:①①Ⅰ:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-43kJ/mol
Ⅲ:CaO(s)+CO2(g)═CaCO3(s)△H=-178.3kJ/mol
根据盖斯定律Ⅰ+Ⅱ+Ⅲ可得:C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g)△H=(+131.0kJ/mol)+(-43kJ/mol)+(-178.3kJ/mol)=-90.3kJ,
故答案为:-90.3;
②A.该反应为放热反应,降低体系的温度,平衡向着正向移动,可以提高氢气的产率,故A正确;
B.该反应为气体体积不变的反应,压缩容器的体积增大了压强,平衡不移动,氢气的产率不变,故B错误;
C.CaO为固体,增加CaO的量平衡不移动,氢气的产率不变,故C错误;
D.选用适当的催化剂可以改变反应速率,但是不影响化学平衡,氢气的产率不变,故D错误;
故答案为:A.
点评 本题考查了化学平衡的影响因素、反应热与焓变的应用,题目难度不大,明确化学平衡及其影响为解答关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的灵活应用能力.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,NH4+、Fe2+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,K+、Ag+、H+、NO3-可以大量共存 | |
| C. | 向该溶液中通入SO2气体,反应的离子方程式为SO2+3CIO-+H2O═SO42-+CI-+2HCIO | |
| D. | 向该溶液中加入浓盐酸,反应的离子方程式为CIO-+CI-+2H+═Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.08g镁铝合金中含有镁和铝的质量分别为1.92g、2.16g | |
| B. | 生成沉淀的最大质量为10.88g | |
| C. | 若白色沉淀只有Mg(OH)2,该NaOH溶液的浓度至少为0.96mol/L | |
| D. | 溶解4.08 g镁铝合金时,剩余盐酸的物质的量为0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

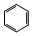 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$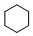
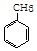 +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$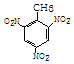 +3H2O,反应类型取代反应
+3H2O,反应类型取代反应 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏烧瓶中盛约$\frac{1}{3}$体积的自来水,并放入几粒沸石[KS5UKS5U] | |
| B. | 可以不用温度计 | |
| C. | 冷水从冷凝管上口入,下口出 | |
| D. | 取少量收集到的液体滴入硝酸银和稀硝酸,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B能形成离子化合物,且A离子半径小于B离子半径 | |
| B. | A、D能形成离子化合物DA5,与H2O反应能生成A的单质 | |
| C. | C、D的简单氢化物中只有D溶于水,其水溶液呈酸性 | |
| D. | E的两种氢化物中所有化学键种类完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com