
标准状况下,将1L可能含有N2,H2,CO,NH3,NO2,H2S杂质的无色SO2气体,依次通过如下图所示的装置。(各容器中液体均为足量)
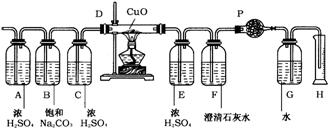
其变化情况是:①气体通过A瓶,浓H2SO4无明显变化,气体体积无变化;②气体通过B瓶,饱和Na2CO3溶液质量增加0.5g,气体体积无变化;③气体通过C瓶后,再通过D管,灼热的CuO中有红色物质生成。冷却后,气体体积变为888ml(标准状况);④将上述气体通过E后,再通入F中,澄清石灰水变浑浊,同时增重1.54g;⑤气体经过干燥管P后,在量筒H中,收集到水104ml。根据以上实验回答:
(1)混合气体中SO2的体积分数为______________。
(2)混合气体中含有的杂质为______________。
(3)混合气体中是否含有H2、CO杂质;若有,指出其体积;若无,说明理由。
a.H2:____________________________________________________________________;
b.CO: ____________________________________________________________________。
(1)56%;(2)N2,H2,CO;(3)H2∶112mL;(4)CO∶224mL
①气体通过浓H2SO4,体积无变化,说明无NH3和H2S(H2S与浓H2SO4发生氧化还原反应)。
②气体通过饱和Na2CO3溶液质量增加0.5g,发生了反应:
SO2+Na2CO3=Na2SO3+CO2 Δm
22.4L ∶ 44g (64-44)g
V(SO2) ∶ m(CO2) 0.5g
V(SO2)=0.56L m(CO2)=1.1g
φ(SO2)=0.56L/1L×100%=56%
③通过灼热的CuO有红色物质生成,说明有还原性气体H2或CO或两者皆有。
④通入澄清石灰水变浑浊,说明有CO2(由两部分组成),且为1.54g,则③中的还原性气体必含CO:
CO ~ CO2 ~ Ca(OH)2
22.4L 4g
V(CO) (1.54g-1.1g)
V(CO)=22.4L×0.44g/44g=0.224L=224mL
⑤最后得到的气体只能是N2,且V(N2)=V(H2O)=104mL,S则V(H2)=1000ml-888mL=112mL。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,将22.4LHCl溶于1L水,可配成1 mol?L-1的稀盐酸 |
| B.将100mL18 mol?L-1的浓H2SO4和100mL水混合,可配成9mol?L-1的H2SO4溶液 |
| C.将0.1molNaCl配成100mL溶液,从中取出10mL,所取出溶液的物质的量浓度为1 mol?L-1 |
| D.将4.0gNaOH 溶于100mL容量瓶中,加水至刻度线,配成1 mol?L-1的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示的框图中,A-I都是由短周期元素组成的常见物质。其中A是气体,它的水溶液呈碱性;氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒;单质E可作半导体材料。
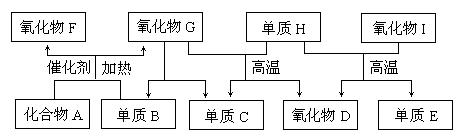
(1)化合物A的化学式是 ,氧化物G的电子式是 。
(2)组成单质E的元素在元素周期表中的位置是 ;单质H和单质E以及氧化物I 均能形成 (填“分子”、“原子”或“离子”)晶体,其中单质E的熔点 (填“高于”、“低于”或“等于”)氧化物I的熔点。
(3)标准状况下,将2.24L氧化物F和1.68L单质B同时通入1L氧化物G中(反应前后溶液体积的变
化忽略不计),发生反应的化学方程式为 ,所得溶液的PH= 。此时再向溶液
中通入2.24L化合物A,完全反应后所得溶液的PH (填“>7”、“<7”或“=7”),用离子方程式
表示其原因: 。
(4)单质B和单质C在一定条件下可组成原电池(用KOH溶液作电解质),则该原电池负极的电极反应式为
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省无锡一中高一(上)期中化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com