
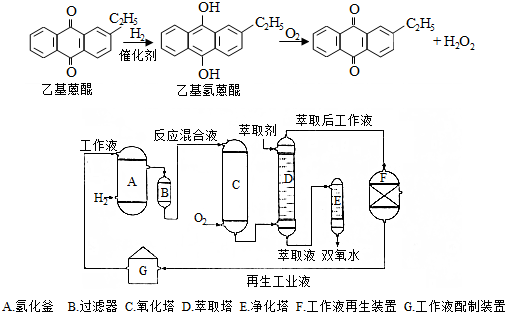
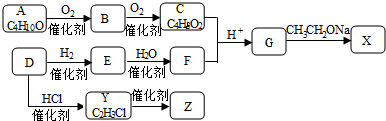
 .进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌.
.进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌.分析 (1)由转化反应可知,先与氢气发生加成反应,再与氧气发生氧化反应;乙基蒽醌开始被消耗,后来又生成;乙基蒽醌不易溶于水,易溶于有机溶剂;
(2)由原理和流程可知,A中乙基蒽醌与氢气反应;进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌;
(3)D中萃取分离出过氧化氢溶液,则选择萃取剂为水;
(4)除净残留的H2O2,因过氧化氢过氧化氢分解放出氧气,与氢气混合,易发生爆炸;
(5)双氧水在酸性条件下与KMnO4溶液发生氧化还原反应生成氧气,结合c=$\frac{1000ρw}{M}$计算浓度.
解答 解:(1)由转化反应可知,乙基蒽醌先与氢气发生加成反应,再与氧气发生氧化反应,则蒽醌法制备H2O2理论上消耗的原料是氢气和氧气;乙基蒽醌开始被消耗,后来又生成,则循环使用的原料是乙基蒽醌,且结合流程图种再生工作液环节可知乙基蒽醌循环使用;配制工作液时采用有机溶剂而不采用水的原因是乙基蒽醌不溶于水,易溶于有机溶剂,
故答案为:氢气和氧气;乙基蒽醌;乙基蒽醌不溶于水,易溶于有机溶剂;
(2)由原理和流程可知,A中乙基蒽醌与氢气反应,反应为 ;进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌,
;进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌,
故答案为: ;乙基氢蒽醌;
;乙基氢蒽醌;
(3)D中萃取分离出过氧化氢溶液,则选择萃取剂为水,选择其作萃取剂的原因是过氧化氢易溶于水被水萃取,乙基蒽醌不溶于水,
故答案为:水;过氧化氢易溶于水被水萃取,乙基蒽醌不溶于水;
(4)工作液再生装置F中要除净残留的H2O2,原因是过氧化氢分解放出氧气,与氢气混合,易发生爆炸,
故答案为:过氧化氢分解放出氧气,与氢气混合,易发生爆炸;
(5)双氧水在酸性条件下与KMnO4溶液发生氧化还原反应生成氧气,离子反应为5H2O2+6H++2MnO4-=2Mn2++5O2↑+8H2O,由c=$\frac{1000ρw}{M}$可知一种双氧水的质量分数为27.5%(密度为1.10g•cm-3),其浓度为$\frac{1000×1.10×27.5%}{34}$=8.90mol/L,
故答案为:5H2O2+6H++2MnO4-=2Mn2++5O2↑+8H2O;8.90.
点评 本题考查物质的制备实验,为高频考点,把握制备实验原理、实验技能、物质的性质为解答的关键,侧重分析与实验能力的考查,注意有机物的性质及应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
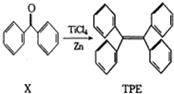
| A. | X的一氯代物有5种 | |
| B. | 1个TPE分子中最多有26个碳原子共面 | |
| C. | TPE不能发生取代反应,但能发生加成反应 | |
| D. | TPE不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g乙烯和丙烯混合气体中的氢原子数为2NA | |
| B. | 1mol N2与4mol H2反应生成的NH3分子数为2NA | |
| C. | 1mol Fe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24L CCl4含有的共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
| A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
| B | 0.01 | c(Na+)>c(AlO2-)>c(OH-)>c(CO32-) |
| C | 0.015 | c(Na+)>c(HCO3-)>c(CO32-)>C(OH-) |
| D | 0.03 | c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
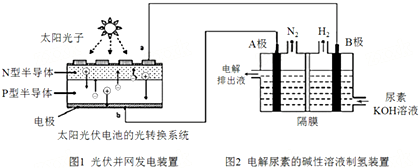
| A. | 图1中N型半导体为负极 | |
| B. | 若A极产生7.00gN2,则此时B极产生16.8L H2(标况下) | |
| C. | 电解完毕后电解液的pH增大 | |
| D. | 该系统工作时,A极的电极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移除导管 |
| C | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
| D | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
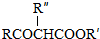
 ;
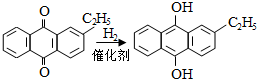
; ,反应类型是取代反应;
,反应类型是取代反应;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com