
甲、乙、丙三种物质之间有如下转化关系:
甲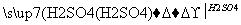 乙
乙 丙
丙 甲
甲
(1)若甲和丙都是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液。
则甲是________,丙是________(填化学式)。写出“乙 丙”转化的离子方程式:______________________________。
丙”转化的离子方程式:______________________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲是______,丙是________(填化学式)。写出“甲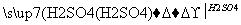 乙”转化的离子方程式:____________________________。
乙”转化的离子方程式:____________________________。
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼 铝的工艺流程如下:
铝的工艺流程如下:
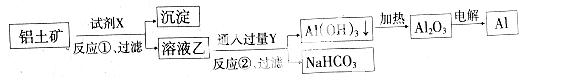
下列叙述正确的是
A.反应 ②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.试剂X可以是氢氧化钠溶液,也可以是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃的下列溶液中,碱性最强的是( )
A.pH=11的溶液
B.[OH-]=0.12 mol·L-1
C.1 L中含有4 g NaOH的溶液
D.[H+]=1×10-10 mol·L-1的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
暗紫色化合物A具有绿色、高电压和高能量
的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在
水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。某兴趣小组的同学对化合物A
进行组成分析,确定A中仅含有O、K、Fe三种元素。取3.96g化合物A的粉末溶于水,滴加足量的稀硫
酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,
得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为 ▲ ;化合物A与H2O反应的离子方程式为 ▲ 。
(2)化合物A还可作为一种“绿色高效多功能”水处理剂。原因是 ▲ 。
(3)化合物A的制备还可通过氧化法,试写出在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式 ▲ 。
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是 ▲
A.亚硫酸钠 B.KOH C.醋酸 D.Fe(NO3)3
(5)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质间的转化关系中不能全部通过一步反应完成的是
A.Na→NaOH→Na2CO3→NaCl B.Mg→MgCl2→MgCO3→Mg(OH)2
C.Al→Al2O3→Al(OH)3→AlCl3 D.Fe→FeCl3→Fe(OH)3→Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液呈血红色,说明不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变血红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得到红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明溶液中只含有Fe2+,不含有Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+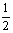 O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s
Fe(s )+CO2(g) △H= 。
)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如右下图所示,其中P端通入CO2。
①石墨I电极上的电极反应式为 。
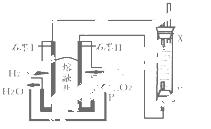 ②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作为电解液
C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH-
D.白色沉淀只能在阳极上产生
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化
为 ,
该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
V、W、X、Y、Z是由周期表中1~20号部分元素组成的5种化合物,其中V、W、X、Z均为两种元素组成。上述5种化合物涉及的所有元素的原子序数之和等于35。它们之间的反应关系如下图:

(1)5种化合物分别是V________、W________、X________、Y________、Z________;(填化学式)
(2)由上述5种化合物中的某2种化合物反应可生成一种新化合物,它包含了5种化合物中的所有元素,生成该化合物的化学方程式是____________________________;
(3)V的电子式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
 最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为2CH3CHO+H2O
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应为2CH3CHO+H2O
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。
(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入 (填化学式)气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应如下:
阳极:①4OH--4e-====O2↑+2H2O
②
阴极:①
②CH3CHO+2e-+2H2O====CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量 (填“增大”“减小”或“不变”)。
(4)已知:乙醛、乙醇的沸点分别为20.8℃、78.4℃。从电解后阴极区的溶液中分离出乙醇粗品的方法是 。
(5)在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛的含量为3 000 mg·L-1的废水,可得到乙醇 kg(计算结果保留小数点后1位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com