

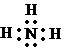 ,丙和氧的反应方程式为4NH3+3O2
,丙和氧的反应方程式为4NH3+3O2
| ||
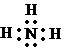 ;4NH3+3O2
;4NH3+3O2
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、实验室将硫酸铜溶液直接加热蒸发至干方法来制取CuSO4?5H2O |
| B、用湿润的pH试纸来检验溶液的pH值 |
| C、用KSCN溶液检验硫酸亚铁溶液是否氧化变质 |
| D、用四氯化碳萃取溴的苯溶液中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:2 |
| C、2:3 | D、3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ、下列是A、B、C、D、E五种短周期元素的某些性质
Ⅰ、下列是A、B、C、D、E五种短周期元素的某些性质| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| X | Y | Z | |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 【化学--物质结构与性质】
【化学--物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
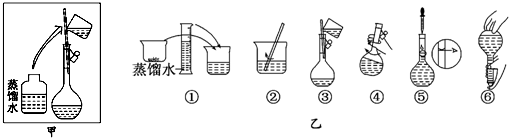
| a | b | c | d | e | |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2molKClO3 |
| B、1mol KCl |
| C、2molMgCl2 |
| D、2molNaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com