
 ����Խϡ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�ͣ�ijͬѧȡ�����Ͻ���������ϡ�������ַ�Ӧû������ų����ڷ�Ӧ�����Һ����μ���4mol•L-1 NaOH��Һ������NaOH��Һ�����������ij��������ʵ����Ĺ�ϵ��ͼ������˵������ȷ���ǣ�������
����Խϡ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�ͣ�ijͬѧȡ�����Ͻ���������ϡ�������ַ�Ӧû������ų����ڷ�Ӧ�����Һ����μ���4mol•L-1 NaOH��Һ������NaOH��Һ�����������ij��������ʵ����Ĺ�ϵ��ͼ������˵������ȷ���ǣ�������| A�� | D����Һ�д��ڣ�c��NH4+��+c��Na+��+c��H+��=c��OH-��+c��NO3-�� | |
| B�� | EF�η�����ѧ��Ӧ�����ӷ���ʽΪ��Al��OH��3+OH-=AlO2-+2H2O | |
| C�� | ԭ��Һ��n��NH4+��=0.012mol | |
| D�� | ��Һ�н��OH-������ǿ��������H+��������������Al3+ |
���� �����Ͻ���������ϡHNO3��ַ�Ӧ��������ΪAl3+��Fe3+��ͨ�����⣬��Ӧʼ��û���������ɣ����Եó������е������������ɣ����������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�ͣ������Ʋ�NԪ����+5�����-3�ۣ���ͼ�ɵ������������������������ҺӦ�������ᷴӦ�������ɳ�������������ȫ����ͼ֪������������������Һ�����������䣬�ɵ���NH4+�����˷�Ӧ��������NaOH�ĵμӣ������ķ�Ӧ�����У�
��H++OH-=H2O����Fe3++3OH-=Fe��OH��3����Al3++3OH-=Al��OH��3������NH4++OH-�TNH3•H2O����Al��OH��3 +OH-=AlO2-+2H2O��
A��D����Һ����Ϊ����狀������ƣ�
B��EF��Ϊ���������ܽ������������У�
C������DE�������������Ƶ��������Ϸ�����Ӧ������Һ��n��NH4+����
D�����ݷ�����Ӧ��˳�����жϽ��OH-������ǿ����
��� �⣺�����Ͻ���������ϡHNO3��ַ�Ӧ��������ΪAl3+��Fe3+��ͨ�����⣬��Ӧʼ��û���������ɣ����Եó������е������������ɣ����������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�ͣ������Ʋ�NԪ����+5�����-3�ۣ���ͼ�ɵ������������������������ҺӦ�������ᷴӦ�������ɳ�������������ȫ����ͼ֪������������������Һ�����������䣬�ɵ���NH4+�����˷�Ӧ��������NaOH�ĵμӣ������ķ�Ӧ�����У�
��H++OH-=H2O����Fe3++3OH-=Fe��OH��3����Al3++3OH-=Al��OH��3������NH4++OH-�TNH3•H2O����Al��OH��3 +OH-=AlO2-+2H2O��
A��D����Һ����Ϊ����狀������ƣ��ɵ���غ��֪ӦΪc��NH4+��+c��Na+��+c��H+��=c��OH-��+c��NO3-������A��ȷ��
B��EF��Ϊ���������ܽ������������У���ӦΪAl��OH��3+OH-=Al��OH��4-����B��ȷ��
C����ͼ��֪DE�������������Ƶ����Ϊ3mol����NH4++OH-�TNH3•H2O��֪��Һ��n��NH4+��=n��OH-��=0.003L��4mol/L=0.012mol����C��ȷ��
D�����ݷ�����Ӧ��˳���֪�����OH-������ǿ��������H+��������������NH4+����D����
��ѡD��
���� ���⿼���Ϊ�ۺϣ��漰����������ķ�Ӧ�����ӷ���ʽ����д��������ԭ��Ӧ����ѧ�����֪ʶ�㣬�����е��Ѷ����⣮������ؼ����жϳ�����Ļ�ԭ�����Լ�����ת���غ�����ã�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
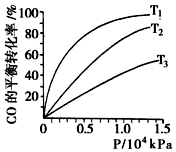 ����β����Ϊ������Ⱦ����Ҫ��Դ֮һ�����д������к����ʣ�����CO��
����β����Ϊ������Ⱦ����Ҫ��Դ֮һ�����д������к����ʣ�����CO��| ������� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |
| CH3OH��g�� | CH3OCH3��g�� | H2O | ||
| �� | 387 | 0.20 | 0.080 | 0.080 |
| �� | 207 | 0.20 | 0.090 | 0.090 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
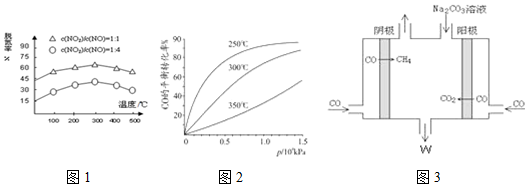
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Һ©������ˮ�����Ȼ�̼�Ļ����ʱ�����Ȼ�̼���Ͽڵ��� | |
| B�� | �ò���������©���е�Һ���Լӿ�����ٶ� | |
| C�� | �����þƾ���ȡ��ˮ�еĵ� | |
| D�� | ��ˮͨ��������Ƶõ�ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��AgNO3��Һ�м���Cu�ۣ�Cu+2Ag+�TCu2++2Ag | |
| B�� | ��CaCl2��Һ��ͨ��CO2��Ca2++CO2+H2O�TCaCO3��+2H+ | |
| C�� | ����FeCl3��Һ�����ˮ����Fe��OH��3���壺Fe3++3H2O�TFe��OH��3��+3H+ | |
| D�� | CuSO4��Һ��Ba��OH��2��Һ��ϣ�Ba2++SO42-�TBaSO4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����� | ʵ������ | ���� |
| A | ��ij��Һ�е����������ᣬȻ������������Ȼ�����Һ | �������������а�ɫ������ | ˵��ԭ��Һ�к���SO42- |
| B | ��ij�Ȼ�������Һ�е���������ˮ��Ȼ�����������KSCN��Һ | ��Һ���Ѫ��ɫ | ˵��ԭ�Ȼ��������������� |
| C | ���ȷֽ�ij��X��������������ͨ�������ữ��BaCl2��Һ | ʵ�鿪ʼ����������ɫ���� | X������NaHCO3 |
| D | ����ҺX�еμ�ϡNaOH��Һ����ʪ���ɫʯ����ֽ�����Թܿ� | ��ֽ������ | ԭ��Һ����NH4+ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
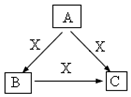 ��Ҫ��������и��⣺
��Ҫ��������и��⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com