

| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
分析 由流程可知软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸过滤得到浸出液调节溶液PH,使铁离子全部沉淀,过滤得到浸出液中主要含有Cu2+、Ca2+等杂质,加入硫化铵和氟化铵,除去Cu2+、Ca2+过滤,在滤液中加入碳酸氢铵和氨水过滤得到混合溶液加热赶出氨气结晶析出得到硫酸铵,滤渣为碳酸锰,通过洗涤、烘干得到硫酸锰晶体,
(1)升高温度、搅拌、减小固体的颗粒等均能加速固体的溶解,据此分析;
(2)FeS2与MnO2反应后生成Fe3+、Mn2+和SO42-,1molFeS2失去15mol电子,1molMnO2得到2mol电子,根据得失电子守恒、原子守恒和电荷守恒分析配平;
(3)除铁工序中,先加入适量的软锰矿,使残余Fe2+转化为Fe3+,加入石灰调节溶液的pH;
(4)根据Ksp(CaF2)=c2(F-)•c(Ca2+)计算;
(5)根据MnCO3的产率与溶液pH、反应时间关系如图分析,纵轴是碳酸锰的产率,横轴为时间,不同PH时的产率变化曲线分析判断,PH越大,产率越大,曲线越陡反应速率越大分析;
(6)根据溶液中含有的离子分析副产品的主要成分.
解答 解:软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸过滤得到浸出液调节溶液PH,使铁离子全部沉淀,过滤得到浸出液中主要含有Cu2+、Ca2+等杂质,加入硫化铵和氟化铵,除去Cu2+、Ca2+过滤,在滤液中加入碳酸氢铵和氨水过滤得到混合溶液加热赶出氨气结晶析出得到硫酸铵,滤渣为碳酸锰,通过洗涤、烘干得到硫酸锰晶体,
(1)升高温度、搅拌、减小固体的颗粒等均能加速固体的溶解,所以为了提高溶浸工序中原料的浸出效率,可以采取的措施有:适当升高温度,搅拌,研磨矿石,
故答案为:AC;
(2)FeS2与MnO2反应后生成Fe3+、Mn2+和SO42-,1molFeS2失去15mol电子,作还原剂,1molMnO2得到2mol电子,作氧化剂,根据得失电子守恒,FeS2的计量数为2,MnO2的计量数为15,所以氧化剂前面的计量数为15,
故答案为:15;
(3)除铁工序中,①先加入适量的软锰矿,使残余Fe2+转化为Fe3+,便于将铁离子沉淀,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,②由表中数据可知三价铁离子完全的沉淀的PH为3.7,铜离子开始沉淀的范围为5.2,所以加入石灰调节溶液的pH的范围为3.7~5.2,
故答案为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;3.7~5.2;
(4)根据题中提供的数据可知,Ksp(CaF2)=c2(F-)•c(Ca2+)=(0.01mol•L-1)2×1.5×10ˉ6mol•L-1=1.5×10ˉ10(mol3•L-3),
故答案为:1.5×10ˉ10(mol3•L-3);
(5)根据MnCO3的产率与溶液pH、反应时间关系如图可知:pH等于7.0时反应到达平衡所用时间最短,即反应速率最快,且MnCO3产率最高,所以pH越大越有利于提升MnCO3的产率,
故答案为:pH越大越有利于提升MnCO3的产率;
(6)溶浸过程中发生的反应生成硫酸根离子,后来又加入了硫化铵、碳酸氢铵,所以产品中含有(NH4)2SO4,
故答案为:(NH4)2SO4.
点评 本题以工业流程图为依托,考查了实验条件的选择、离子方程式的书写、Ksp的计算等,题目难度中等,解题关键是合理分析题中生成流程及表中离子完全沉淀时的数据的含义,试题培养了学生分析、理解能力及灵活应用所学知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2+O2$?_{加热}^{催化剂}$ 2SO 3△H=-196.6 kJ/mol | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O( l )△H=-285.8 kJ/mol | |
| C. | 2H2( g )+O2( g )═2H2O ( l )△H=+571.6 kJ/mol | |
| D. | C(s)+O2( g )═CO2(g)△H=+393.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温、常压下,11.2L N2含有的分子数为0.5 NA | |
| B. | 0.5 NA个氯气分子的物质的量是0.5mol | |
| C. | 标准状况下,18g H2O的体积是22.4L | |
| D. | 0.1 mol•L-1稀硫酸中含硫酸根个数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g Na2O2中含有的阴离子数目为0.2 NA | |
| B. | 0.1mol Fe与足量稀HNO3反应,转移电子数为0.3NA | |
| C. | 1L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2 NA | |
| D. | 标准状况下,2.24L CHCl3的分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| B. | 药皂中加入少量苯酚,可以起到杀菌消毒的作用 | |
| C. | 石油是混合物,其分馏产品汽油为纯净物 | |
| D. | 金属铝需经过特别处理才具有抗腐蚀能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
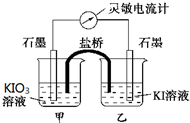 将反应IO3-+5I-+6H+?3I2+3H2O设计成如图所示的原电池,甲、乙烧杯中都加入淀粉溶液.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转.下列判断不正确的是( )
将反应IO3-+5I-+6H+?3I2+3H2O设计成如图所示的原电池,甲、乙烧杯中都加入淀粉溶液.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转.下列判断不正确的是( )| A. | 两次电流计指针偏转方向相反,电流计读数为零时,反应达到化学平衡状态 | |
| B. | 两次实验中,盐桥中的阳离子移动方向相反 | |
| C. | 开始加入少量浓硫酸时,只有乙烧杯中溶液变蓝 | |
| D. | 向甲烧杯中滴入几滴浓NaOH溶液后,乙中石墨电极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,71g Cl2中所含分子数为NA | |
| B. | 0.1mol/L的H2SO3溶液中,c(H+):c(SO32-)>2:1 | |
| C. | 2L 0.6mol/L的Fe2(SO4)3溶液中,含Fe3+离子总数为2.4NA | |
| D. | 1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com