
�о�CO2��CH4����Ӧʹ֮ת��ΪCO��H2���Լ���ȼ��Σ������С����ЧӦ������Ҫ�����塣
��1����֪��2CO��g��+O2��g����2CO2��g�� ��H����566kJ/mol
2H2��g��+O2��g����2H2O��g�� ��H����484kJ/mol
CH4��g��+2O2��g����CO2��g��+2H2O��g�� ��H����890kJ/mol
��CH4��g��+CO2��g����2CO��g��+2H2��g����H��____________��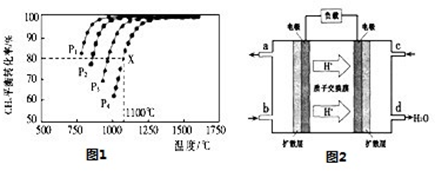
(2)���ܱ�������ͨ�����ʵ���Ũ�Ⱦ�Ϊ0.1mol/L��CH4��CO2����һ�������·�����ӦCH4��g��+CO2��g����2CO��g��+2H2��g�������CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ��ͼ1��
��������ʵ��˵���÷�Ӧһ���ﵽƽ����� ��
a��CO2��Ũ�Ȳ��ٷ����仯
b��������CH4����2������CO��
c����������ƽ����Է��������������仯
d��CO��H2�����ʵ�����Ϊ1:1
�ھ�ͼ��֪��P1��P2��P3��P4�ɴ�С��˳��Ϊ ��
����ѹǿΪP4��1100��������£��÷�Ӧ5minʱ�ﵽƽ��x�㣬����CO��ʾ�÷�Ӧ������Ϊ �����¶��£���Ӧ��ƽ�ⳣ��Ϊ ��
(3)��CO��H2�ɺϳɼ״�(CH3OH)���Լ״���������Ӧ�Ƴɵ�ȼ�ϵ����ͼ2��ʾ���õ�ع�������O2Ӧ�� (�c��һb��)��ͨ�ˣ���ظ�����ӦʽΪ �����øõ�ص�⾫��ͭ��ÿ�õ�6. 4gͭ��ת�Ƶ�����ĿΪ ��
��16�֣���1����160kJ/mol��2�֣� ��2����a��c��2�֣� ��P4��P3��P2��P1��2�֣�
��0.032mol/(L?min)��1.64��2�֣�
��3��c��2�֣���CH3OH��H2O��12e����CO2����6H+��2�֣���1.204��1023��0.2NA��2�֣�
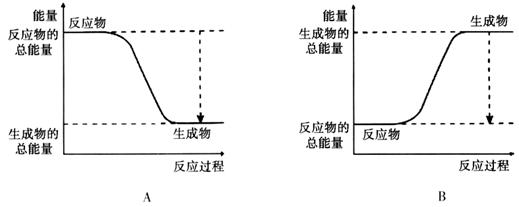
���������������1����֪����2CO��g��+O2��g����2CO2��g�� ��H����566kJ/mol����2H2��g��+O2��g����2H2O��g�� ��H����484kJ/mol����CH4��g��+2O2��g����CO2��g��+2H2O��g�� ��H����890kJ/mol����˸��ݸ�˹���ɿ�֪���ۣ��٣��ڼ��÷�ӦCH4��g��+CO2��g����2CO��g��+2H2��g�������Ը÷�Ӧ�ķ�Ӧ�ȡ�H����890kJ/mol��566kJ/mol��484kJ/mol����160kJ/mol��
��1������һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬�����ݷ���ʽCH4��g��+CO2��g����2CO��g��+2H2��g����֪���÷�Ӧ���������Ŀ��淴Ӧ����a��ƽ��ʱ��Ӧ��������ֵ�Ũ�Ȳ��䣬CO2��Ũ�Ȳ��ٷ����仯��˵������ƽ�⣬��a��ȷ��b������(CH4)��2����(CO)�������(CH4):����(CO)��2:1�������ڻ�ѧ������֮�ȣ�δ����ƽ��״̬������Ӧ���ʴ����淴Ӧ���ʣ�ƽ��������Ӧ���У���b����c���������ƽ����Է��������ǻ�����������ͻ�������ܵ����ʵ����ı�ֵ����Ӧ���������������䣬�淴Ӧ���У���Ӧ�������ܵ����ʵ�������ƽ����Է���������С����������ƽ����Է��������������仯��˵������ƽ�⣬��c��ȷ��d��CO��H2�Ļ�ѧ������Ϊ1:1����Ӧ��ֵ�����ʵ�����Ϊ1:1���У�����˵������ƽ�⣬��d����ѡac��
�ڸ���ͼ��֪���¶�һ��ʱ�������ת���ʦ�(P1)����(P2)����(P3)����(P4)�����ڸ÷�Ӧ����Ӧ�������������ķ�Ӧ������ѹǿƽ�����淴Ӧ���У������ת���ʽ��ͣ���ѹǿP1��P2��P3��P4�ɴ�С��˳��ΪP4��P3��P2��P1��
�۸���ͼ1��֪��ѹǿΪP4��1100��������£��÷�Ӧ5minʱ�ﵽƽ��X�㣬��ʱ�����ת����Ϊ80%����˼����Ũ�ȱ仯��Ϊ0.1mol/L��80%��0.08mol/L����v(CH4)�� ��0.016mol/(L?min)����������֮�ȵ��ڻ�ѧ������֮�ȿ�֪��v(CO)��2v v(CH4)��2��0.016mol/(L?min)��0.032mol/(L?min)��
��0.016mol/(L?min)����������֮�ȵ��ڻ�ѧ������֮�ȿ�֪��v(CO)��2v v(CH4)��2��0.016mol/(L?min)��0.032mol/(L?min)��
CH4��g��+CO2��g����2CO��g��+2H2��g��
��ʼŨ�ȣ�mol/L�� 0.1 0.1 0 0
ת��Ũ�ȣ�mol/L�� 0.08 0.08 0.16 0.16
ƽ��Ũ�ȣ�mol/L�� 0.02 0.02 0.16 0.16
���Ը��¶���ƽ�ⳣ��K�� ��
�� ��1.64
��1.64
��3����ͼ2��֪�������������ת�Ƶ��ұߣ�������������ɣ�����߷���������Ӧ���ұ߷�����ԭ��Ӧ����Ӧ�������õ����ӣ�������ԭ��Ӧ����������c��ͨ�룬�缫�ܷ�ӦʽΪ 2CH3OH��3O2��2CO2����4H2O�������缫��ӦʽΪ3O2��12H+��12e����6H2O���ܷ�Ӧʽ��ȥ������Ӧʽ�ɵø����缫��ӦʽΪ��CH3OH��H2O��12e����CO2����6H+��ͭ�����ʵ���Ϊ6.4g��64g/mol��0.1mol�����ݵ���ת���غ��֪��ת�Ƶ��ӵ���ͭ����ת��Ϊͭ��õĵ��ӣ���ת�Ƶ�����ĿΪ0.1mol��2��NAmol��1��0.2NA��
���㣺�����˹���ɵ�Ӧ�ã�ƽ��״̬���жϡ����������ƽ��״̬��Ӱ�죻��Ӧ���ʺ�ƽ�ⳣ���ļ��㣻�绯ѧԭ����Ӧ���Լ��йؼ����


 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д� �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����֪2H2��g��+O2��g��=2H2O��l����H����571.6 kJ/mol��
CO��g����1/2O2��g����CO2��g����H����283.0 kJ/mol��ijH2��CO�Ļ��������ȫȼ��ʱ�ų�113.74 kJ������ͬʱ����3.6 gҺ̬ˮ����ԭ���������H2��CO�����ʵ���֮��Ϊ___________��
��2���Լ״�������������������ҺΪԭ�ϣ�ʯīΪ�缫���ɹ���ȼ�ϵ�أ���֪��ȼ�ϵ�ص��ܷ�Ӧʽ�ǣ�2CH3OH +3O2+4OH-=2CO32-+6H2O����ȼ�ϵ�ط�����Ӧʱ����������Һ��PH__________ (����� ����С�� ���䡱)�õ�صĸ�����ӦʽΪ_________________��
��3�� ������ȼ�ϵ�ؽ��д�ͭ�ľ�������ͭӦ���ӵ�Դ��________�����ô�ͭ�������ص�������ӦʽΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��15�֣��������糧�ͷų������������NOx����SO2��CO2���������ɻ������⡣��ȼú���������������������̼�ȴ�������ʵ����ɫ���������ܼ��š��������õ�Ŀ�ġ�
��1�����������ü������ԭNOx��
CH4(g) �� 4NO2(g) ��4NO(g) �� CO2(g) �� 2H2O(g) ��H1����574 kJ��mol��1
CH4(g) �� 4NO(g) ��2N2(g) �� CO2(g) �� 2H2O(g) ��H2����1160 kJ��mol��1
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ ��
��2����̼����CO2ת��Ϊ�״���CO2(g)��3H2(g) CH3OH(g)��H2O(g) ��H3
CH3OH(g)��H2O(g) ��H3

����һ���º����ܱ������г���1 mol CO2��3 mol H2����������Ӧ�����CO2��CH3OH(g)Ũ����ʱ��仯��ͼ1��ʾ���ش�0~10 min�ڣ�������ƽ����Ӧ����Ϊ mol/(L��min)����10 min�����¶Ȳ��䣬����ܱ��������ٳ���1 mol CO2(g)��1 mol H2O(g)����ƽ�� ������������������ƶ���
��ȡ��ݵ������CO2��H2�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1��3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״�����������գ�CH3OH���뷴Ӧ�¶�T�Ĺ�ϵ������ͼ2��ʾ��������CO2ת��Ϊ�״��ķ�Ӧ�ġ�H3 0�����������������������
��3����������Na2SO3��Һ���ѳ������е�SO2��Na2SO3����NaOH��Һ����SO2�Ƶá�NaOH��Һ����SO2�Ĺ����У�pH��n(SO32-)�Un(HSO3��)�仯��ϵ���±���
| n(SO32��)�Un(HSO3��) | 91�U9 | 1�U1 | 9�U91 |
| pH | 8.2 | 7.2 | 6.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��14�֣��������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���Ӧ��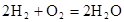 ��
��
��1��Ϊ�˼ӿ�����Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ��________������ţ���ͬ����
| A��ʹ�ô��� | B�����������Ũ�� |
| C����߷�Ӧ���¶� | D�����ͷ�Ӧ���¶� |
| ��ѧ�� | H��H | O��O | H��O |
���� | 436 | 496 | 463 |
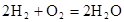 �����У�������________�������������������________��Ӧ�����������ԭ��������·��ÿת��0��2mol���ӣ���״��������H2�������________L��
�����У�������________�������������������________��Ӧ�����������ԭ��������·��ÿת��0��2mol���ӣ���״��������H2�������________L���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��֪�����Ȼ�ѧ����ʽ��
��C(s)+O2(g)=CO2(g) ��H1 ����393.5 kJ��mol-1
��2CO(g)+O2(g)=2CO2(g) ��H2 ����566.0 kJ��mol-1
��2H2(g)+O2(g)=2H2O(l) ��H3 ����571.6 kJ��mol-1
ͨ�����㣨Ҫ�м�����̣���д��1 mol C��Һ̬H2O��Ӧ����CO��H2���Ȼ�ѧ����ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�о�̼���仯������ۺ����öԴٽ���̼���Ĺ���������Ҫ�����塣
��1������ʱ����CO��ԭMgSO4���Ʊ��ߴ�MgO��
��750��ʱ����������к������ʵ���SO2��SO3����ʱ��Ӧ�Ļ�ѧ����ʽ�� _____��
����MgO���Ƴɡ�þ�����������Ρ���أ���װ��ʾ��ͼ��ͼ1���õ�������ĵ缫��ӦʽΪ_________��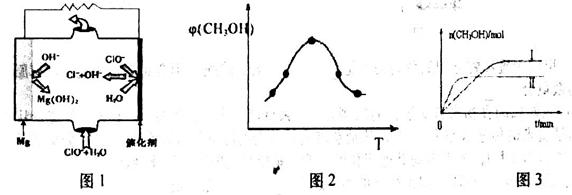
��2��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
CO2(g)��3H2(g) CH3OH(g) ��H��QkJ/mol
CH3OH(g) ��H��QkJ/mol
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK��_______��
��ȡ��ݵ����CO2��H2�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1:3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������з���������Ӧ����Ӧ��ͬʱ����ü״����������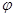 ( CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ������ͼ2��ʾ����������Ӧ��Q_____0���������������������
( CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ������ͼ2��ʾ����������Ӧ��Q_____0���������������������
�����������������У����CH3OH�����ʵ�����ʱ��仯��ͼ3��ʾ������I��II��Ӧ��ƽ�ⳣ����С��ϵΪK1_________K11���������������������
��3����H2��CO����ԭNO���Դﵽ������Ⱦ��Ŀ�ġ�
��֪��2NO(g)��N2(g)��O2(g) ��H����180.5kJ/mol
2H2O(l)=2H2(g)��O2(g) ��H��+571.6kJ/mol
��H2(g)��NO(g)��Ӧ����N2(g)��H2O(l)���Ȼ�ѧ����ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
PM2.5������ο������Ⱦ������ȼú������أ�ȼú��ͬʱ�ŷŴ�����CO2��SO2��NOx
��1������п�ѧ��������룺�ѿ������뱥��̼�����Һ��Ȼ���ٰ�CO2����Һ����ȡ����������ѧ��Ӧ��ʹ֮��Ϊ������ȼ�ϼ״���
����֪�ڳ��³�ѹ�£�
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ?H = ��1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ?H = ��566.0 kJ/mol
H2O(g)=H2O(1) ?H = ��44.0 kJ/mol
��״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ_____________________��
���Լ״���������Ӧ�Ƴɵ�ȼ�ϵ����ͼ��ʾ���õ�ع���������O2Ӧ��______���c����b������ͨ�룬��ظ�����ӦʽΪ__________________��
��25��ʱ�����״�ȼ�����ɵ�����CO2ͨ�뵽Ũ��Ϊ0.lmol��L-1��NaOH��Һ�У�������Һ��pH��8����Һ������Ũ���ɴ�С��˳����_________________��
��2����֪��һ�������£�NO��NO2�������з�Ӧ��NO��g��+NO2��g����N2O3��g������H��0���÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��˵��tlʱ�̴ﵽƽ��״̬����____________��
��3����һ���̶��ݻ�Ϊ5L���ܱ������г���0.20molSO2��0.l0molO2������Ӻ�ﵽƽ�⣬��������к�SO30.18mol����v��O2��=__________��������ͨ��0.20mo1SO2��0.lmolO2����ƽ��____________�ƶ����������Ӧ���������淴Ӧ����������
��4����һ�������£�NO2���Ա�NH3��ԭΪN2������NO2�Ի�����ɵ���Ⱦ��25��ʱ����NH3����ˮ��l00mL 0.lmol��L���İ�ˮ�����pH=11�����������NH3��H2O�ĵ���ƽ�ⳣ��ԼΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO(g)+2H2(g) CH3OH(g) ��H1=��116 kJ��mol��1
CH3OH(g) ��H1=��116 kJ��mol��1
��1�������й�������Ӧ��˵����ȷ����________��
a�����¡����������£������ڵ�ѹǿ�������仯����淴Ӧ�ﵽƽ��
b��һ�������£�H2������������CO���������ʵ�2��ʱ���淴Ӧ�ﵽƽ��
c����������������䣬�����¶ȿ����CO��ת����
d��ʹ�ú��ʵĴ��������̴ﵽƽ���ʱ�䲢���CH3OH�IJ���
��2�����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230�桢250�桢270�������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1mol����COƽ��ת���ʵĹ�ϵ��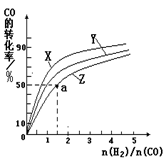
�������������¶��У�����Z��Ӧ���¶��� ��
������ͼ��a���Ӧ�����ݣ�����÷�Ӧ�ڶ�Ӧ�¶��µ�ƽ�ⳣ��K ��д��������̣���
���ڴ����Ӧλ���ϻ�����������Ӧ�ﵽƽ���С��ϵѹǿ���ﵽ�µ�ƽ������У����淴Ӧ������ʱ��ı仯��ϵͼ����ע��
��3����֪��CO(g)+ O2(g)=CO2(g) ��H2=��283 kJ��mol��1
O2(g)=CO2(g) ��H2=��283 kJ��mol��1
H2(g)+ O2(g)=H2O(g) ��H3=��242 kJ��mol��1
O2(g)=H2O(g) ��H3=��242 kJ��mol��1
���ʾ1mol��̬�״���ȫȼ������CO 2��ˮ����ʱ���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����������ʢ�й���ϡ������Թ��У���Ӱ�������������ʵ�������
| A�������Ũ�� | B�������ı���� | C����Һ���¶� | D��������Na2SO4���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com