
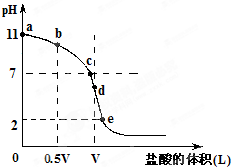
 常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:| c(H+) |
| c(OH-) |
c(N
| ||
| c(NH3?H2O) |
| c(NH3?H20)?c(H+) | ||
c(N
|
| 10-14 |
| 10-11 |
| 10-14 |
| 10-11 |
| 10-3×10-3 |
| 0.1 |
| c(H+) |
| c(OH-) |
| c(NH3?H2O)?c(H+) |
| c(NH4+) |
| 0.1mol/L×VL |
| V |
| 0.1mol/L×XL-0.1mol/L×VL |
| (X+V)L |
| 11V |
| 9 |
| 11V |
| 9 |


科目:高中化学 来源: 题型:
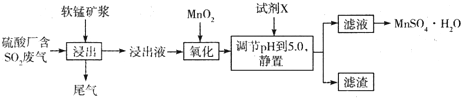
| 离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
| 开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 |
| 完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去N2中的少量O2:通过灼热的CuO粉末,收集气体 |
| B、除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 |
| C、除去CO2中的少量HCl:通入Na2CO3溶液,收集气体 |
| D、除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LH2O含有的质子数为NA |
| B、等物质的量的氮气和氧气,都含有2NA个原子 |
| C、常温常压下,1.06gNa2CO3含有的Na+离子数为0.02 NA |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向浸取液中加入BaCl2有白色沉淀,说明其中含有SO42- |
| B、向浸取液中加入AgNO3溶液有白色沉淀,说明其中含有Cl- |
| C、洁净的铂丝蘸取浸取液少许,在酒精灯火焰上灼烧,火焰呈黄色,不能确定是否含K+ |
| D、向浸取液中滴加稀硫酸,产生无色无味的气体,说明其中含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某溶液加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有HCO3-或CO32- |
| B、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| C、欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| D、将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com