
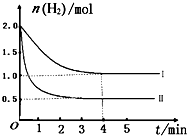
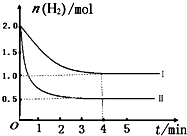
工业上用CO来生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应过程中能量的变化情况;图2表示一定温度下,向固定体积为2 L的容器中加入4 mol H2和一定量的CO后,CO(g)和CH3OH(g)的物质的量
CH3OH(g)。图1表示反应过程中能量的变化情况;图2表示一定温度下,向固定体积为2 L的容器中加入4 mol H2和一定量的CO后,CO(g)和CH3OH(g)的物质的量
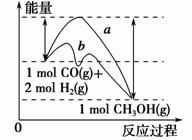

请回答下列问题:
(1)在图1中,曲线________(填“a”或“b”)表示反应使用了催化剂;该反应属于________(填“吸热”或“放热”)反应。
(2)根据图2判断下列说法中正确的是________(填序号)。ks5u
a.起始充入的CO的物质的量为2 mol b.增大CO的浓度,CO的转化率增大
c.容器中压强恒定时,说明反应已达平衡状态
d.保持温度和密闭容器的容积不变,再充入1 mol CO和2 mol H2,再次达到平衡时,n(CH3OH)/n(CO)的值会变小。
(3)从反应开始至达到平衡,v(H2)=________。该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为________;若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数将________(填“增大”“减小”或“不变”)。
CH3OH(g)的化学平衡常数为________;若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数将________(填“增大”“减小”或“不变”)。
(4)已知CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ·mol-1,H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,请写出32 g CH3OH(g)完全燃烧生成CO2和液态水的热化学方程式:___________________。
O2(g)===CO2(g)+2H2O(g) ΔH=-192.9 kJ·mol-1,H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,请写出32 g CH3OH(g)完全燃烧生成CO2和液态水的热化学方程式:___________________。
科目:高中化学 来源: 题型:阅读理解
 (2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.
(2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
| c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省文登市高三3月模拟考试化学试卷(解析版) 题型:填空题
近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)在2升的密闭容器中,充有2mol CO与4mol 水蒸气,在催化剂作用下进行如下化学反应:CO(g)+H2O(g) CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
|
t(℃) |
750 |
850 |
1000 |
|
CO% |
0.7 |
2/3 |
0.5 |
1000℃时该反应的平衡常数为___________________。850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此时反应___________(填“向右进行”、“向左进行”或“处于平衡状态”)。
(2)已知:C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
则CO和H2O生成CO2和H2的热化学方程式为_______________________________。
(3) 目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________;
②若改变条件使平衡向正反应方向移动,则平衡常数______________(填序号)
a.可能不变 b.可能减小 c.可能增大 d.不变、减小、增大皆有可能
(4)NaHCO3的水溶液呈碱性,其原因是(用文字叙述)_______________________。常温下,向100mL
0.2mol/LNaHCO3溶液中滴加amol/L的醋酸溶液,当滴加到溶液呈中性时,所用去的醋酸体积刚好也
为100mL,此时醋酸的电离常数为b, 用含b的代数式表示醋酸的浓度a=_____________________。
查看答案和解析>>
科目:高中化学 来源:临沂三模 题型:问答题
| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
| c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源:2013年山东省临沂市高考化学三模试卷(解析版) 题型:解答题
| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
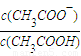 =______.
=______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com