
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x的值:__________________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备。
答案 (1)n(Cl)=0.025 0 L×0.40 mol·L-1=
0.010 mol
0.54 g-0.010 mol×35.5 g·mol-1=0.185 g
n(Fe)=0.185 g/56 g·mol-1≈0.003 3 mol
n(Fe)∶n(Cl)=0.003 3∶0.010≈1∶3,x=3
(2)0.10 盐酸 氯气
解析 解答此题的关键是明确阴离子交换柱交换出的OH-的物质的量等于Cl-的物质的量,从而求出FeClx中x的值。
(1)首先明确阳离子交换柱和阴离子交换柱的作用,根据离子等量交换,溶液中OH-的物质的量等于FeClx中Cl-的物质的量。通过中和滴定知n(OH-)=n(H+)=
0.40 mol·L-1×25.0×10-3 L=0.010 mol,故n(Cl-)=0.010 mol。
FeClx中Fe元素的质量为0.54 g-35.5 g·mol-1×0.010 mol=0.185 g
FeClx中Fe元素与Cl元素的物质的量之比为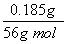 ∶0.010 mol≈1∶3,故x=3。
∶0.010 mol≈1∶3,故x=3。
(2)根据题意可设该混合物的组成为FeCl2.1,利用十字交叉法可得样品中FeCl3的物质的量分数为0.10。注意制备FeCl2选用弱氧化剂,制备FeCl3选用强氧化剂。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
近年来,我国某些地区出现了私自滥采黄金的现象,提炼过程一般要使用化学药品氰化物,其直接后果是 ( )。
①污染水体 ②破坏臭氧层 ③危害工人的生命与健康
④破坏植被
A.①② B.①②③
C.②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是一个有机物的核磁共振氢谱图,请你观察图谱,分析其可能是下列物质中的( )

A.CH3CH2CH2CH3 B.(CH3)2CHCH3
C.CH3CH2CH2OH D.CH3CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时,最佳顺序为( )
①加入足量氯水 ②加入足量酸性KMnO4溶液 ③加入少量NH4SCN溶液
A.①③ B.③②
C.③① D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在指定溶液中能大量共存的是( )
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO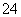
B.1.0 mol·L-1的FeCl2溶液:NO 、Na+、K+、ClO-
、Na+、K+、ClO-
C.使酚酞变红的溶液中:Na+、Cl-、SO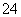 、Fe3+
、Fe3+
D.酸性溶液中:NO 、SO
、SO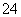 、Fe3+、Mg2+
、Fe3+、Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
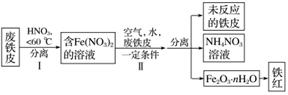
①步骤Ⅰ若温度过高,将导致硝酸分解。硝酸分解的化学方程式为________________________________________________________________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O===2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为
________________________________________________________________________。
③上述生产流程中,能体现“绿色化学”思想的是___________________________________
________________________________________________________________________(任写一项)。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物是中学化学中的一类重要物质,下列关于铁元素的叙述中正确的是( )
A.2Fe3++Fe===3Fe2+成立说明氧化性:Fe3+>Fe2+
B.25 ℃,pH=0的溶液中,Al3+、NH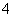 、NO
、NO 、Fe2+可以大量共存
、Fe2+可以大量共存
C.5.6 g铁与足量的氯气反应失去电子为0.2 mol
D.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+===Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填写下列空白
(1)CH3CHCH2+( )—→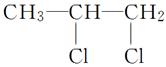 ,反应类型:________。
,反应类型:________。
 (2)CH3CHCH2+Cl2500℃~600℃( )+HCl,反应类型:________。
(2)CH3CHCH2+Cl2500℃~600℃( )+HCl,反应类型:________。
(3)CH2CHCHCH2+( )—→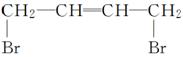 ,反应类型:________。
,反应类型:________。
(4)( )+Br2—→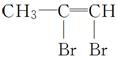 ,反应类型:____________。
,反应类型:____________。
(5)( ) 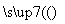 ,
,  ,反应类型:____________。
,反应类型:____________。
(6)CH3CHCH2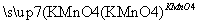 CH3COOH+
CH3COOH+
( ),反应类型:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为( )
A.2 B.3 C.4 D.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com