
| 选项 | 操作 | 现象 | 结论 |
| A | 将饱和FeCl3溶液滴入沸水中 | 溶液变红褐色 | 有Fe(OH)3生成 |
| B | 用燃烧的镁条引燃铝热剂 | 剧烈反应 | 该反应是吸热反应 |
| C | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中含有SO42- |
| D | 用导线连接铜片和锌片后插进盐酸中 | 铜片上有气泡 | 铜片是原电池的正极 |
| A、A | B、B | C、C | D、D |


 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
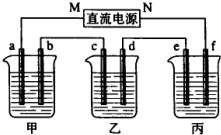 如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:
如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 环境 |  |
 |
 |
 |
| 行为 | 切勿随意进入 | 严禁烟火 | 尽量远离 | 顺风向低处跑 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶质物质的量相等的Ba(OH)2与KAl(SO4)2?12H2O溶液混合:Ba2++6OH-+2Al3++SO
| ||||
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | ||||
C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO
| ||||
D、将适量CO2通入Ca(ClO)2溶液中:2ClO-+CO2+H2O═CO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、轮船水线以下的船壳上镶嵌有一定量的锌块 |
| B、黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
| C、锌跟稀硫酸反应制取氢气,加入少量硫酸铜能加快反应速率 |
| D、铝在空气中不易腐蚀,不用特殊方法保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同物质的量浓度的①CH3COONa溶液②NaNO3溶液③NH4Cl溶液④NaOH溶液,pH的大小顺序是:④>①>②>③ |
| B、在Na2SO3和NaHSO3混合液中:c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(SO32-) |
| C、相同条件下,pH=10的CH3COONa溶液和氨水中,由水电离出的c(OH-)前者大于后者 |
| D、某溶液中只含Na+、CH3COO-、H+、OH-四种离子,则溶液一定呈现碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量的SO2通人NaOH溶液中:SO2+2OH-=SO32-+H2O |
| B、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
| C、碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D、少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 180℃ |
| 催化剂 |
| CO2 |
| 反应Ⅰ |
| Na2SO3水溶液 |
| 反应Ⅱ |
| 浓度/mol?L-1/ 时间/min |
NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:
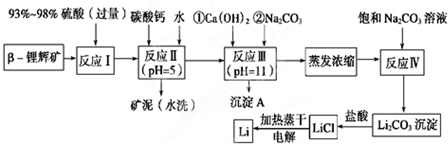
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com