
【题目】AF是几种烃分子的球棍模型(如下图所示),据此冋答下列问题:
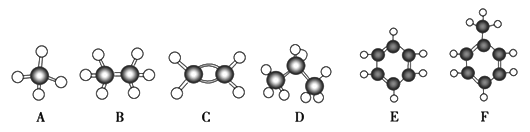
(1)含碳量最高的烃是(填对应字母)____________________
(2)能够发生加成反应的烃有(填对应字母)__________________
(3)写出F与液溴反应的化学方程式__________________
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
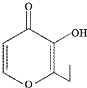
A. 该有机物的分子式为C7H7O3
B. 该有机物能发生取代、加成和氧化反应
C. 1mol该有机物最多能与2mol H2发生加成反应
D. 该有机物的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在现行元素周期表中,所含元素种数最多的族和周期分别是( )
A.第ⅠA族 第6周期
B.第Ⅷ族 第6周期
C.第ⅢB族 第6周期
D.第ⅢA族 第6周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图,下列说法正确的是( )

A. 镁作Y电极
B. 电池工作时,Na+向负极移动
C. 废液的pH大于NaClO溶液的pH
D. X电极上发生的反应为ClO-+2H2O - 4e-═ClO3-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 实验室用 50 mL 0.50 mol·L-1 盐酸、50 mL 0.55 mol·L-1 NaOH 溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
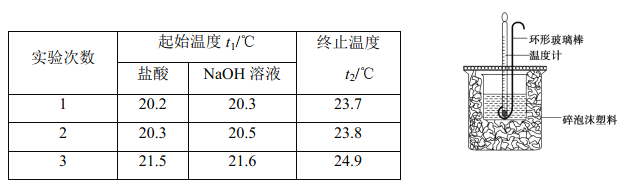
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是_____________;不能用铜丝搅拌棒代替环形玻璃棒的理由是____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热 ΔH=___________[盐酸和NaOH溶液的密度按1g·cm-3 计算,反应后混合溶液的比热容(c)按4.18 J·(g· ℃)-1 计算]。
(3)若将 NaOH 溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则 ΔH1 与ΔH的关系为:ΔH1________ΔH( 填 “ < ” 、 “ > ” 或 “ = ”) , 理由是_____________________。
Ⅱ.某学生用 0.1 mol·L-1 的 KOH 标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20 mL 待测盐酸注入洁净的锥形瓶,并加入 2~3 滴酚酞
B.用标准溶液润洗滴定管 2~3 次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准 KOH 溶液注入碱式滴定管至“0”刻度以上 1~2 cm
E.调节液面至“0”或“0”以下某一刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准 KOH 溶液滴定至终点并记下滴定管液面的刻度就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)__________________;
(2)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是__________________;
(3)判断到达滴定终点的实验现象是____________________;
(4)若称取一定量的 KOH 固体(含少量 NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.原电池的负极得到电子,发生还原反应
B.原电池中较活泼的金属作正极
C.原电池中的电极一定要由两种不同的金属组成
D.原电池中发生氧化反应的电极是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定是酸性的是
A.pH=6的某电解质的溶液 B.c(H+) > 1×10-7mol/L
C.溶液中含有H+ D.溶液中c(OH-) < c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、 [Cu(NH3)4]2+(深蓝色)等形式存在。CuCl为难溶于水的白色固体。回答下列问题:
(1)在浓的强碱溶液中,Cu2+与Al3+的化学性质相似。在少量的CuSO4溶液中,逐渐加入浓的NaOH溶液直至过量,可观察到的现象是_____________________。
(2)CuCl溶于浓盐酸时发生的反应为CuCl+HCl![]() H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是___________________。在热的CuCl2溶液中加入铜粉,可制得CuCl,其反应的离子方程式为___________________,但实际上该反应较难持续进行,其原因是____________________,使反应彻底进行的操作是___________________。
H[CuCl2],要从H[CuCl2]溶液中析出沉淀的方法是___________________。在热的CuCl2溶液中加入铜粉,可制得CuCl,其反应的离子方程式为___________________,但实际上该反应较难持续进行,其原因是____________________,使反应彻底进行的操作是___________________。
(3)[Cu(H2O)4]2+和[Cu(NH3)4]2+在溶液中可以相互转化。:t℃时,初始浓度为1molL-1的CuSO4溶液中{ Cu2+实际以[Cu(H2O)4]2+的形式存在},[Cu(NH3)4]2+的浓度随氨水浓度[c(NH3)]的变化如图所示
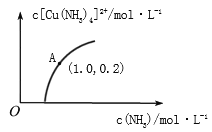
①CuSO4溶液与过量氨水发生反应的总的离子方程式为________________。
②由图可知,溶液的酸性增大,[Cu(H2O)4]2+ 转化为[Cu(NH3)4]2+的平衡转化率___________(填“增大”“减小”或“不变”)。根据A点数据,计算出该温度下的平衡常数K=__________。
③升高温度,溶液中[Cu(H2O)4]2+的平衡转化率减小,则该反应的ΔH_____(填“>”“<”或“=”)0
④硫酸四氯合铜{[Cu(NH3)4]SO4}在碱性镀铜工艺中常用作电镀液的主要成分,电镀时,要控制局部温度不得高于150℃,可能的原因是_______________。电解时。阴极的电极反应式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com