
【题目】根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是
①向![]() 溶液中滴加
溶液中滴加![]() 溶液,再加入
溶液,再加入![]() 振荡,
振荡,![]() 层呈紫色
层呈紫色
②向![]() 溶液中加入氯水,再加入
溶液中加入氯水,再加入![]() 溶液,呈红色
溶液,呈红色
③向![]() 溶液中加入浓盐酸,振荡后紫色褪去
溶液中加入浓盐酸,振荡后紫色褪去
A.![]() B.
B.![]()
C.![]() D.
D.![]()
科目:高中化学 来源: 题型:
【题目】乙二酸(![]() )俗称草酸,在实验研究和化学工业中应用广泛。完成下列填空:
)俗称草酸,在实验研究和化学工业中应用广泛。完成下列填空:
(1)室温下,测得![]() 溶液的
溶液的![]() ,写出草酸的电离方程式______。
,写出草酸的电离方程式______。
(2)草酸溶液中微粒的物质的量分数随溶液![]() 变化如图所示:
变化如图所示:
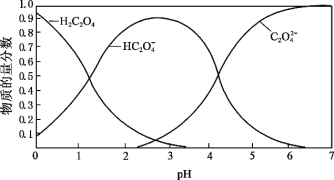
i.向草酸溶液中滴加![]() 溶液至
溶液至![]() 时发生的主要反应的离子方程式是:_______。
时发生的主要反应的离子方程式是:_______。
ii.继续加入![]() ,调节
,调节![]() 由2.5直至大于6.5,调节过程中
由2.5直至大于6.5,调节过程中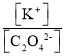 比值将________(选填“增大”、“减小”或“不变”)。
比值将________(选填“增大”、“减小”或“不变”)。
(3)工业上制取草酸的原理为:![]()
该反应的平衡常数表达式![]() _______,下列能说明反应已经达到平衡的是______。
_______,下列能说明反应已经达到平衡的是______。
a 平衡常数K保持不变 b 反应液的pH保持不变
c 丁醇的浓度保持不变 d 反应液的总质量保持不变
(4)草酸可用于测定高锰酸钾的质量分数,原理如下:![]()
i.一定条件下,测得上述反应中溶液中![]() 的浓度随反应时间的变化如图,以
的浓度随反应时间的变化如图,以![]() 浓度的变化表示此反应
浓度的变化表示此反应![]() 内的平均反应速率为____________
内的平均反应速率为____________![]()
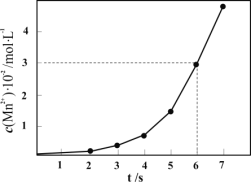
ii.分析![]() 的浓度随反应时间的变化的可能原因(反应过程中温度没有明显变化)_____。
的浓度随反应时间的变化的可能原因(反应过程中温度没有明显变化)_____。
(5)取![]() 的高锰酸钾产品,配成
的高锰酸钾产品,配成![]() 溶液,取出
溶液,取出![]() ,消耗
,消耗![]() 草酸标准溶液
草酸标准溶液![]() ,则样品中高锰酸钾的质量分数为______。
,则样品中高锰酸钾的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是重要的气体燃料和化工原料。回答下列问题:
(1)已知![]() 、
、![]() 、
、![]() 的燃烧热分别为
的燃烧热分别为![]() ,
,![]() ,
,![]() 。利用甲烷制备合成气的反应为
。利用甲烷制备合成气的反应为![]()
![]() 。
。
根据上述数据能否计算![]() ________(填“能”或“否”),理由是________________。
________(填“能”或“否”),理由是________________。
(2)在某密闭容器中通入![]()
![]() 和
和![]() ,在不同条件下发生反应:
,在不同条件下发生反应:
![]()
![]()
测得平衡时![]() 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。
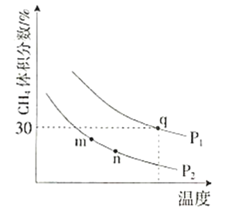
①![]() ________
________![]() ,
,![]() ________(填“<”、“>”或“=”)。
________(填“<”、“>”或“=”)。
②m、n、q三点的化学平衡常数大小关系为________。
③q点甲烷的转化率为________,该条件下的化学平衡常数![]() ________(用含有
________(用含有![]() 的表达式表示,
的表达式表示,![]() 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
(3)用甲烷和![]() 构成的燃料电池电解
构成的燃料电池电解![]() 溶液,装置如下图所示。反应开始后,观察到x电极附近出现白色沉淀。则A处通入的气体是
溶液,装置如下图所示。反应开始后,观察到x电极附近出现白色沉淀。则A处通入的气体是
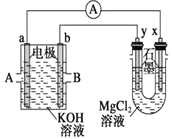
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学欲除去固体氯化钠中混有的氯化钙,请据如下实验方案回答问题。

(1)操作1的名称是_________;
(2)反应①中加入略过量的A物质的目的是_________________________;判断A已过量的实验操作方法是________________________。
(3)写出反应②的化学方程式:______________________________。如果加入盐酸过量,则对所得到的氯化钠的纯度_________(填“有”或“没有”)影响。
(4)实验时称取样品的质量为185.0g,经过操作1后,测得沉淀(不溶于水)的质量为50.0g,则样品中NaCl的质量分数是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯),下列说法正确的是( )
Si(纯),下列说法正确的是( )
A.步骤①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B.步骤①、②、③中每生成或反应1 mol Si,转移4 mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一个铝制易拉罐充满![]() 后,再往罐内注入足量的
后,再往罐内注入足量的![]() 溶液,立即用胶布严封罐口,不多会儿就会听到罐内“咔、咔”作响,发现易拉罐变瘪,再过一会儿易拉罐又鼓涨起来,解释上述变化的实验现象.
溶液,立即用胶布严封罐口,不多会儿就会听到罐内“咔、咔”作响,发现易拉罐变瘪,再过一会儿易拉罐又鼓涨起来,解释上述变化的实验现象.
(1)易拉罐开始变瘪的原因是___________,其离子方程式(或化学方程式)为___________.
(2)易拉罐后来又鼓涨起来的原因是_____________,其离子方程式(或化学方程式)为_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究氨的还原性及检验产物的性质,按下图装置进行实验(图中夹持装置已略去)。将B处的三氧化二铬加热至红热,再鼓入空气,已知:无水氯化钙可吸收氨气和水。回答下列问题:
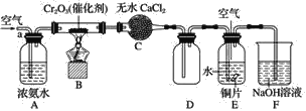
(1)B中发生反应的化学方程式是______________________________。
(2)证明氨气发生催化氧化的现象是________________,反应的方程式是________________。
(3)E中铜发生反应的离子方程式是________________________________。
(4)E中缓缓通入空气的目的是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1∶2;②NO2的生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧
C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2—可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
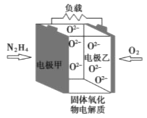
A.电池内的O2—由电极甲移向电极乙
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上有1molN2H4消耗时,标况下乙电极上有22.4LO2参与反应
D.电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com