
【题目】图1所示的氮循环是生态系统物质循环的重要组成部分,人类活动加剧了氮循环中的物质转化。
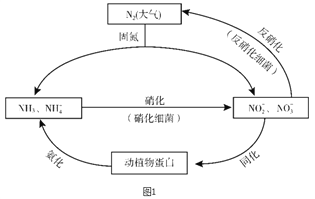
(1)结合上图判断下列说法正确的是________(填字母序号)。
A. 固氮过程中,N2只做氧化剂
B. 在硝化细菌作用下发生的硝化过程需要有氧化剂参与
C. 反硝化过程有助于弥补人工固氮对氮循环造成的影响
D. 同化、氨化过程中,氮元素均从无机物转移至有机物
(2)硝化过程中,NH3转化成HNO2的反应的化学方程式为_______。
(3)反硝化过程中,CH3OH可作为反应的还原剂,请将该反应的离子方程式补充完整:5CH3OH + 6NO3- ![]() N2↑ + 4HCO3- +□______+□
N2↑ + 4HCO3- +□______+□
(4)利用下表数据进行估算,写出工业合成氨反应的热化学方程式:_______。
共价键 | N≡N | H—H | N—H |
断开1mol共价键所需能量(kJ) | 946 | 436 | 391 |
(5)电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图2和图3所示。
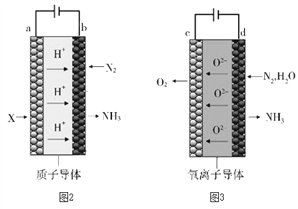
①图2中,a电极上通入的X为_______。
②图3中,d电极上的电极反应式为_______。
③若图2和图3装置的通电时间相同、电流强度相等,电解效率分别为80%和60%,则两种装置中产生氨气的物质的量之比为_______。
【答案】 BC 2NH3 + 3O2 ![]() 2HNO2 + 2H2O 5CH3OH + 6NO3-
2HNO2 + 2H2O 5CH3OH + 6NO3- ![]() 3N2↑ + 4HCO3- + CO32- + 8H2O N2(g) + 3H2(g)
3N2↑ + 4HCO3- + CO32- + 8H2O N2(g) + 3H2(g) ![]() 2NH3(g) ΔH= -92 kJ·mol-1 H2 N2 + 3H2O + 6e-
2NH3(g) ΔH= -92 kJ·mol-1 H2 N2 + 3H2O + 6e- ![]() 2NH3 + 3O2- 4∶3
2NH3 + 3O2- 4∶3
【解析】(1)A. 根据图示,固氮过程中,N2可以转化为氨气,也可以转化为NO3-,氮气既可以做氧化剂,也可以做还原剂,故A错误;B. 在硝化细菌作用下,氨气发生硝化反应生成NO3-,氨气被氧化,需要有氧化剂参与,故B正确;C. 固氮过程中,N2可以转化为氨气,也可以转化为NO3-,反硝化过程中又将NO3-转化为氮气,有助于弥补人工固氮对氮循环造成的影响,故B正确;D. 氨化过程中,将无机物氨气转化为蛋白质等有机物,故D错误;故选BC;
(2)硝化过程中,NH3转化成HNO2的反应的化学方程式为2NH3 + 3O2 = 2HNO2 + 2H2O,故答案为:2NH3 + 3O2 = 2HNO2 + 2H2O;
(3)反硝化过程中,CH3OH可作为反应的还原剂,反应的离子方程式为5CH3OH + 6NO3- ![]() 3N2↑ + 4HCO3- + CO32- + 8H2O,故答案为:5CH3OH + 6NO3-
3N2↑ + 4HCO3- + CO32- + 8H2O,故答案为:5CH3OH + 6NO3- ![]() 3N2↑ + 4HCO3- + CO32- + 8H2O;
3N2↑ + 4HCO3- + CO32- + 8H2O;
(4)工业合成氨反应的化学方程式为N2+ 3H2 ![]() 2NH3,△H=反应物总键能-生成物总键能=946 kJ·mol-1+3×436 kJ·mol-1-6×391 kJ·mol-1= -92 kJ·mol-1,故答案为:N2(g) + 3H2(g)
2NH3,△H=反应物总键能-生成物总键能=946 kJ·mol-1+3×436 kJ·mol-1-6×391 kJ·mol-1= -92 kJ·mol-1,故答案为:N2(g) + 3H2(g) ![]() 2NH3(g) ΔH= -92 kJ·mol-1;
2NH3(g) ΔH= -92 kJ·mol-1;
(5)①根据图示,a为阳极,氢气失去电子生成氢离子,故答案为:氢气;
②图3中,d电极为阴极,氮气和水得到电子生成氨气和O2-,电极反应式为N2 + 3H2O + 6e- = 2NH3 + 3O2-,故答案为:N2 + 3H2O + 6e- = 2NH3 + 3O2-;
③若图2和图3装置的通电时间相同、电流强度相等,电解效率分别为80%和,图2中阳极H2—2e-=2H+,图3中阴极N2 + 3H2O + 6e- = 2NH3 + 3O2-,生成1mol氨气,转移3mol电子,则转移相同的电子,生成的氨气的物质的量之比80%:60%=4:3,故答案为:4:3。


科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L HCl完全溶于水得到V mL盐酸,溶液的密度为ρ g·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是
①c=![]() ×100% ②c=
×100% ②c=![]() ③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1,则加入水的体积应大于50 mL
③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1,则加入水的体积应大于50 mL
A. ①④ B. ②③
C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 淀粉和纤维素都是纯净物
B. 油脂都不能使溴的四氯化碳溶液褪色
C. 蔗糖和淀粉都不能使新制氢氧化铜在加热条件下还原成红色沉淀
D. 羊毛、棉花的主要成分都是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2,有关该电池的说法正确的是
A. 充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O
B. 充电过程是化学能转化为电能的过程
C. 放电时负极附近溶液的碱性不变
D. 放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲、乙、丙为组成生物体的相关化合物,乙为一个由α、β、γ三条多肽链形成的蛋白质分子,共含271个氨基酸,图中每条虚线表示由两个硫基(-SH)脱氢形成一个二硫键(-S-S-)。下列相关叙述不正确的是
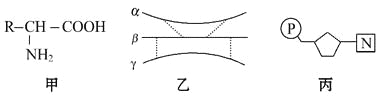
A. 甲为组成乙的基本单位,且乙中最多含有20种甲
B. 由不同的甲形成乙后,相对分子质量比原来少了4 832
C. 丙主要存在于细胞核中,且在乙的生物合成中具有重要作用
D. 如果甲中的R为C3H5O2,则由两分子甲形成的化合物中含有16个H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图是生物体内四种有机物的组成与功能关系图,乙图是二糖的组成图,请据图回答下列问题。

(1)构成细胞的最基本元素是_____________,生物体内含量最多的有机化合物是图中的_______(填字母)
(2)甲图中物质D的基本元素组成是________;物质C的不同取决于_________的不同。
(3)小麦种子细胞中,物质E是指__________________。
(4)相同质量的E和F彻底氧化分解,耗氧量较多的是_____________。
(5)乙图B、C代表的单糖分别是_______、___________(填写具体名称)。不能水解的糖类是_____糖,构成淀粉、纤维素、糖原等多糖的单体都是____________________。
(6)淀粉→麦芽糖→葡萄糖→糖原,这是某生物体内糖类的某些变化,此生物一定是________(填“动物”或“植物”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24LHF所含分子数为0.1NA
B. 某温度下,2LpH=12的NaOH溶液中含OH-的数目为0.02NA
C. 丙烯和环丙烷组成的42g混合气体分子中共用电子对总数为9NA
D. 化学反应中每生成1molO2,转移的电子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池充电时间短,续航能力强,被誉为“完美电池”,工作原理如图1所示,反应的离子方程式为:VO2++V3++H2O![]() VO2++V2++2H+。以此电池电解Na2SO3溶液(电极材料为石墨),可再生NaOH,同时得到H2SO4,其原理如图2所示。下列说法错误的是
VO2++V2++2H+。以此电池电解Na2SO3溶液(电极材料为石墨),可再生NaOH,同时得到H2SO4,其原理如图2所示。下列说法错误的是
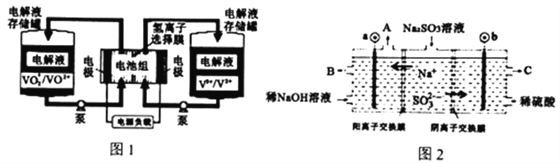
A. 电解Na2SO3溶液时,a极与电池负极相连,图1中H+从电池右边移向左边
B. 电池充电时,正极电极反应为VO2++e-+2H+=VO2++H2O
C. 电解时b的电极反应式为SO32-+H2O-2e-=SO42-+2H+
D. 若电解过程中图2所有液体进出口密闭,则消耗12.6gNa2SO3,阴极区变化的质量为4.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)
后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为_____mol·L-1。
(2)取用任意体积的该盐溶液时,下列物理量中会随所取体积的多少而变化的是________(填字母)。
A.溶液中NaClO的物质的量 B.溶液的浓度
C.溶液中NaClO的摩尔质量 D.溶液的密度
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。回答下列问题。
①如图所示的仪器中,有些是不需要,配制上述溶液还需要_____________玻璃仪器

②需要称量NaClO固体的质量为_______ g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________ mL。
③若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是_______。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容 D.定容时,仰视溶液的凹液面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com