

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| 1.将铝片放入饱和氯化铜溶液中,反应较快,浸在溶液中的铝片表面迅速生成蓬松的红色固体,同时在液面处的铝片以及有液体飞溅到上部的铝片表面有黑色物质生成.2.有大量气泡产生,在一段时间内产生气泡越来越快,将其收集并点燃发出爆鸣声.3.有少量蓝色悬浊液产生. |
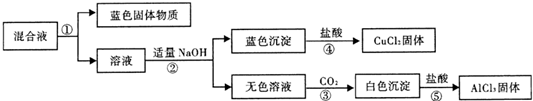
| 预设验证方法 | 猜想的现象 | 结论 |
| 取适量覆盖有黑色物质的铝片于试管中, |
黑色物质含铜,可能是纳米铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
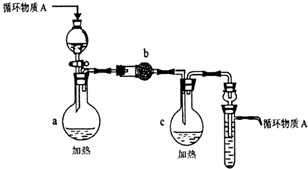
 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄 振荡后CCl4层无明显变化 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
| Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省攀枝花市高三第二次统考理综化学试卷(解析版) 题型:实验题
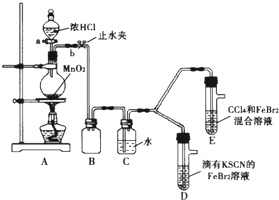
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1)①连接仪器:把玻璃导管插入橡胶塞的操作是: ,然后对准橡胶塞上得空稍稍用力转动,将其插入。
②检查气体发生装置A的气密性的操作是: ,向分液漏斗中注水,若水不能顺利流下,则气密性良好。
(2)整套实验装置存在一处明显不足,请指出 。
用改正后的装置进行实验。实验过程如下:

(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化:
D装置中:红色慢慢褪去。
E装置中:CC14层先由无色变为橙色,后颜色逐渐变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:

①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因 ,请设计简单实验证明上述解释: 。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因 。
查看答案和解析>>
科目:高中化学 来源:2014届北京市高三上学期第一次月考化学试卷(解析版) 题型:实验题
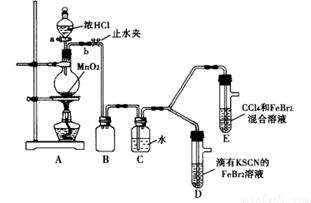
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
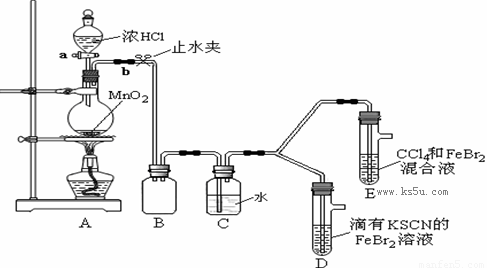
①检查气体发生装置A的气密性的操作是 。
②整套实验装置存在一处明显的不足,请指出: 。
(2)用改正后的装置进行实验,实验过程如下:
|
实验操作 |
实验现象 |
结论 |
|
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 |
D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:
|
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
|
ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2 。 ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因:
,
请设计简单实验证明上述解释: 。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因: 。
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com