
 A、B、C、D、E五中物质都含有同一种元素,它们按图所示的关系相互转化,已知A为单质,C为一种淡黄色的固体,
A、B、C、D、E五中物质都含有同一种元素,它们按图所示的关系相互转化,已知A为单质,C为一种淡黄色的固体,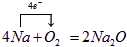 ,
,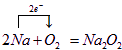 ,
,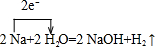 ,
,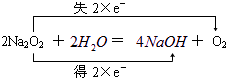 ,
,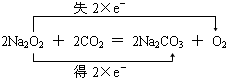 ,
,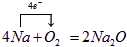 ;
;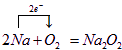 ;
;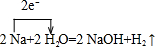 ;
;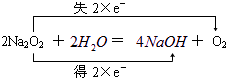 ;
;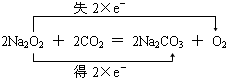 ;4NaOH+CO2=Na2CO3+2Na2O.
;4NaOH+CO2=Na2CO3+2Na2O.


科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| A、常温时,中性溶液的pH=7,AG=0 |
| B、酸性溶液的AG>0,AG越大,溶液的pH越小 |
| C、碱性溶液的AG>0,AG越大,溶液的pH越大 |
| D、常温下,0.1 mol/LNaOH溶液,AG=-12,pH=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 所需仪器 |
| 1. | 烧杯、玻璃棒 |
| 2.向溶液中滴加Na2CO3溶液至 | 烧杯、 |
| 3. | 铁架台、玻璃棒、烧杯、 |
| 4.滴加 | |
| 5. | 三脚架、玻璃棒、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol?L-1 | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol?L-1 | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| 试验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g1 |
| ① | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
| ② | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| ③ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使紫色石蕊试液变红的溶液中:Na+、K+、AlO2-、CO32- |
| B、氢氧化铁胶体:H+、K+、S2-、Br- |
| C、高锰酸钾溶液:H+、K+、SO42-、葡萄糖 |
| D、室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com