
| A. | 常温下,准确称取14.8gCa(OH)2,配置100mL2.0mol/L的Ca(OH)2溶液 | |
| B. | 在溴富集过程中,可在分液漏斗中加入1mL溴水,再向其中加入3mL四氯化碳,震荡,静置、分液,得下层液体 | |
| C. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业上从海带中提取碘经历的步骤有:浸泡-过滤-氧化-萃取-粗碘提纯 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体时停止加热 |
分析 A.氢氧化钙是微溶物;
B.溴水与四氯化碳比例应为溴水较多;
C.从海带中提取单质碘,灼烧、溶解后以碘离子存在,需要加氧化剂氧化生成碘单质,然后萃取即可;
D.蒸发皿中的溶液不能完全蒸干,当大量晶体析出时,要用余热来蒸干.
解答 解:A.氢氧化钙是微溶物,不能得到2mol/L的氢氧化钙溶液,故A错误;
B.溴的萃取实验中,溴水体积较大,四氯化碳体积较小,故B错误;
C.从海带中提取单质碘,灼烧溶解后以碘离子存在,需要加氧化剂氧化生成碘单质,然后萃取即可,即步骤为灼烧-浸泡-过滤-氧化-萃取-分液-粗碘提纯,故C错误;
D.用蒸发方法使NaCl从溶液中析出时,蒸发皿中有大量晶体析出时,停止加热,要用余热来蒸干,故D正确;
故选CD.
点评 本题考查化学实验方案评价,为高频考点,涉及蒸发操作、碘的制取、溶液配制等知识点,明确实验原理及物质性质是解本题关键,注意操作规范性及基本操作方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 17g NH3所含的电子数是 10NA | |
| B. | 常温常压下,22.4L氧气含氧原子数为2NA | |
| C. | 5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA | |
| D. | 2.3g金属钠全部变成钠离子时失去的电子数是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
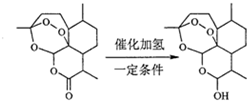
| A. | 青蒿素分子中治疗疟疾的活性基团是过氧基 | |
| B. | 双氢青蒿素分子比青蒿素分子多1个手性碳原子 | |
| C. | 理论上每摩尔青蒿素水解需要消耗1molNaOH | |
| D. | 每摩尔双氢青蒿素可以与1molNaHCO3反应生成1molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥⑦ | B. | ①②⑤⑦⑧ | C. | ②③④⑤⑥ | D. | ①③⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 向酸性KMnO4溶液中滴加足量H2O2 | 溶液的紫红色消失 | 双氧水有漂白性 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向某无色溶液中滴加足量稀盐酸 | 产生白色沉淀 | 该无色溶液中一定存在Ag+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
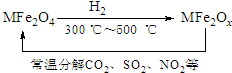 新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温与H2反应制得.常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图:
新型纳米材料氧缺位铁酸盐MFe2Ox(3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温与H2反应制得.常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
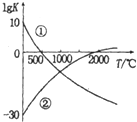 氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,如图表示两个常见固氮反应的平衡常数对数值(IgK)与温度的关系:
氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,如图表示两个常见固氮反应的平衡常数对数值(IgK)与温度的关系:| A. | 反应①和②均为放热反应 | |
| B. | 升高温度,反应①的反应速率减小 | |
| C. | 在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大 | |
| D. | 在1000℃时,反应①和反应②体系中N2的浓度一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com