
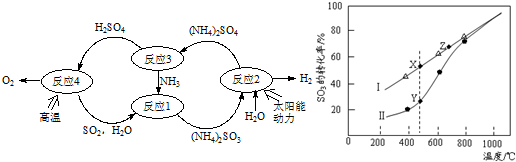
分析 (1)反应1是二氧化硫和氨气在水中反应生成亚硫酸铵的反应;
(2)据图分析,反应2是太阳能转化为电能,电解亚硫酸铵生成硫酸铵和氢气;
(3)硫酸铵在400℃时分解,产物除水蒸气外还有A、B、C三种气体,A是空气中含量最多的单质,则为氮气,B能使湿润的红色石蕊试纸变蓝,为氨气,C能使品红溶液褪色,为二氧化硫;
(4)①利用已知热化学方程式,据盖斯定律书写H2SO4(l)分解为SO2(g)、O2(g)及H2O(g)的热化学方程式;
②i)据图可知,随温度的升高,三氧化硫的平衡转化率增大,说明三氧化硫分解是吸热反应,温度越高,平衡常数越大;
ii)Y点时反应还没有达到平衡状态,正向进行;
iii)温度的升高,曲线b向曲线a逼近,反应速率加快.
解答 解:(1)反应1是二氧化硫和氨气在水中反应生成亚硫酸铵的反应,反应的离子方程式为SO2+H2O+2NH3=2NH4++SO32-,
故答案为:SO2+H2O+2NH3=2NH4++SO32-;
(2)据图分析,反应2是太阳能转化为电能,电解亚硫酸铵生成硫酸铵和氢气,
故答案为:太阳能转化为电能再转化为化学能;
(3)硫酸铵在400℃时分解,产物除水蒸气外还有A、B、C三种气体,A是空气中含量最多的单质,则为氮气,B能使湿润的红色石蕊试纸变蓝,为氨气,C能使品红溶液褪色,为二氧化硫,反应的化学方程式为3(NH4)2SO4$\frac{\underline{\;400℃\;}}{\;}$4NH3↑+N2↑+3SO2↑+6H2↑,
故答案为:3(NH4)2SO4$\frac{\underline{\;400℃\;}}{\;}$4NH3↑+N2↑+3SO2↑+6H2↑;
(4)①已知H2SO4(l)=SO3(g)+H2O(g),△H=+177kJ•mol-1…(a)
2SO3(g)?2SO2(g)+O2(g),△H=+196kJ•mol-1…(b)
据盖斯定律,2a+b得:2H2SO4(l)?2SO2(g)+O2(g)+2H2O(g)△H=+550kJ•mol-1,
故答案为:2H2SO4(l)?2SO2(g)+O2(g)+2H2O(g)△H=+550kJ•mol-1;
②i)据图可知,随温度的升高,三氧化硫的平衡转化率增大,说明三氧化硫分解是吸热反应,温度越高,平衡常数越大,所以K(X)<K(Z),
故答案为:<;
ii)Y点时反应还没有达到平衡状态,正向进行,所以正反应速率大于逆反应速率,
故答案为:>;
iii)温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,
故答案为:温度升高,反应速率加快,达到平衡时间缩短.
点评 本题考查了离子方程式书写、能量转化形式、化学方程式书写、热化学方程式书写、化学平衡移动等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度相等的①NH4C1、②(NH4)2S04、③NH4HS04溶液中,c(NH4+)的大小顺序:②>③>① | |
| B. | 0.2 mol•L-1CH3COOH溶液和0.2 mol•L-1CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| C. | pH=2的H2SO3溶液与pH=12的NaOH溶液等体积混合:c(HSO3-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
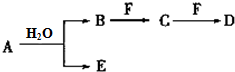 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题: ;D中所含化学键的类型离子键和共价键.
;D中所含化学键的类型离子键和共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2、SO3、P4和C6H6都是非极性分子 | |
| B. | 在H3O+和[Cu(H2O)4]2+中都存在配位键 | |
| C. | 元素电负性越大的原子,该元素的原子吸引键合电子的能力越强 | |
| D. | 在电中性晶体中只要含有阳离子,则一定含有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将适量氯化铁饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体 | |
| B. | 若需要使用0.100mol/L的CuSO4溶液480ml,可用12g胆矾及相应容器配制 | |
| C. | 用分液漏斗、烧杯、漏斗架、饱和碳酸钠溶液可除去乙酸乙酯中的乙酸 | |
| D. | 实验室从海带里提取碘的过程是:灼烧、溶解、过滤、萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸、NaCl溶液是实验室常见的强电解质 | |
| B. | 二氧化氮经加压凝成无色液体为物理变化 | |
| C. | Na2O•SiO2是一种简单的硅酸盐,可溶于水 | |
| D. | 溴水滴入植物油中振荡褪色,说明溴被植物油从溴水中萃取出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均存在电离平衡和水解平衡 | |
| B. | 存在的粒子种类不相同 | |
| C. | c(OH-)前者小于后者 | |
| D. | 分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将含0.001 mol FeCl3的溶液全部滴到沸水中,可形成0.001 mol Fe(OH)3胶体粒子 | |
| B. | 胶体可以透过半透膜 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 直径介于1 nm~100 nm之间的微粒称为胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com