
| A. | ①③⑤⑦⑧ | B. | ②④⑦ | C. | ①⑥ | D. | ②④⑥⑧ |
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 检验试液中的SO42-:试液$\stackrel{BaCl_{2}溶液}{→}$ 白色沉淀$\stackrel{HCl溶液}{→}$ 白色沉淀 | |
| B. | 检验试液中的Cl-:试液$\stackrel{稀H_{2}SO_{4}}{→}$无沉淀$\stackrel{AgNO_{3}溶液}{→}$ 白色沉淀 | |
| C. | 检验试液中的Fe2+:试液$\stackrel{氯水}{→}$无明显现象$\stackrel{KSCN溶液}{→}$血红色溶液 | |
| D. | 检验试液中的NH4+:试液$→_{供热}^{NaOH溶液}$气体逸出$→_{石蕊试纸}^{湿润的红色}$ 试纸变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
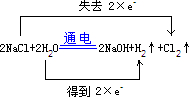 .有人用图3所示装置制取消毒液(主要成分为NaClO),其中A极为阴极,B极为阳极,则阳极的产物为Cl2(填化学式).
.有人用图3所示装置制取消毒液(主要成分为NaClO),其中A极为阴极,B极为阳极,则阳极的产物为Cl2(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4、BaCl2、HNO3 | B. | KNO3、Na2CO3、CaCl2 | ||
| C. | MgSO4、NaOH、H2SO4 | D. | AgNO3、NaCl、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子一定比原子大 | |
| B. | 所有原子的原子核都是由质子和中子构成 | |
| C. | 分子、原子、离子都是构成物质的粒子 | |
| D. | 物质状态发生变化,是因为粒子大小发生了变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L 氮气所含的原子数目为NA | |
| B. | 在反应3SiO2+6C+2N2=Si3N4+6CO,生成1 mol Si3N4时共转移12 NA电子 | |
| C. | 1molNa2O2固体中含离子总数为4 NA | |
| D. | 25℃时pH=13的NaOH溶液中含有Na+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | 向氯化铁溶液中加入NaOH溶液,可制得Fe(OH)3胶体 | |
| C. | 固体的NaCl不导电,熔融态的NaCl可以导电 | |
| D. | 在河流入海口处易形成三角洲原理与胶体的性质无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com