
【题目】铜的+1价化合物如Cu2O、CuCl都是重要的化工产品,研究它们的制备及其性质具有重大的现实意义.
(1)Cu2O是一种具有独特光、磁特性的红棕色p型半导体材料.
(i)工业上可以用新制Cu(OH)2悬浊液与液态肼(N2H4)反应制备Cu2O,同时放出N2 , 下列对应的化学反应方程式:
(ii)已知常温下,溶液中的Cu+易在酸性条件下发生反应:2Cu+=Cu2++Cu.写出稀硫酸与Cu2O反应的离子方程式
(2)氯化亚铜(CuCl)微溶欲水,不溶于酒精,在潮湿空气中易水解氧化.某课外小组以某工业废渣(主要成分为硅,铜,碳等)为原料制备CuCl的流程示意图如图: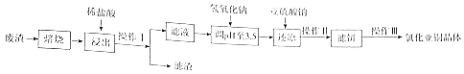
(i)“滤渣”的主要成分为(填化学式).
(ii)“还原”过程中SO32﹣将Cu2+还原为CuCl,请写出反应的例子方程式: , 亚硫酸钠需适当过量,目的有 .
(iii)操作Ⅰ和操作Ⅱ所用的玻璃仪器为 . 操作Ⅲ包括对滤饼的醇洗,干燥,使用无水乙醇代替水进行洗涤的优点是
(iv)CuCl是共价化合物,经测定其蒸气对H2的相对密度为99.5,测它的准确的分子式为
【答案】
(1)4Cu(OH)2+N2H4 ![]() N2↑+2Cu2O+6H2O;Cu2O+2H+═Cu+Cu2++H2O
N2↑+2Cu2O+6H2O;Cu2O+2H+═Cu+Cu2++H2O
(2)SiO2;2Cu2++SO32﹣+2Cl﹣+H2O=2CuCl↓+SO42﹣+2H﹢;防止生成的CuCl被氧化;漏斗、烧杯、玻璃棒;减小洗涤CuCl时的溶解损失并防止其水解氧化;Cu2Cl2
【解析】解:(1)(i)根据反应物N2H4和Cu(OH)2 , 生成物是Cu2O、H2O和N2 , 可得化学方程式为4Cu(OH)2+N2H4 ![]() N2↑+2Cu2O+6H2O,所以答案是:4Cu(OH)2+N2H4
N2↑+2Cu2O+6H2O,所以答案是:4Cu(OH)2+N2H4 ![]() N2↑+2Cu2O+6H2O;(ii)氧化亚铜(Cu2O)在酸性条件下不稳定,生成Cu和Cu2+ , 反应的离子方程式为:Cu2O+2H+═Cu+Cu2++H2O,
N2↑+2Cu2O+6H2O;(ii)氧化亚铜(Cu2O)在酸性条件下不稳定,生成Cu和Cu2+ , 反应的离子方程式为:Cu2O+2H+═Cu+Cu2++H2O,
所以答案是:Cu2O+2H+═Cu+Cu2++H2O;(2)工业废渣(主要成分为硅,铜,碳等)焙烧后得固体为硅和铜的氧化物,用盐酸浸取后得氯化铜溶液和二氧化硅固体,过滤得滤渣为SiO2 , 滤液为氯化铜溶液,滤液中加氢氧化钠调节PH值为3.5,再加亚硫酸钠还原得氯化亚铜沉淀,过滤后得滤饼,对滤饼的醇洗,干燥,得氯化亚铜晶体,(i)根据上面的分析可知,“滤渣”的主要成分为SiO2 ,
所以答案是:SiO2;(ii)“还原”过程中SO32﹣将Cu2+还原为CuCl,反应的离子方程式为:2Cu2++SO32﹣+2Cl﹣+H2O=2CuCl↓+SO42﹣+2H﹢ , 亚硫酸钠需适当过量,防止生成的CuCl被氧化,
所以答案是:2Cu2++SO32﹣+2Cl﹣+H2O=2CuCl↓+SO42﹣+2H﹢;防止生成的CuCl被氧化;(iii)操作i和操作ii均为过滤,所用的玻璃仪器为漏斗、烧杯、玻璃棒,使用无水乙醇代替水进行洗涤的优点是 减小洗涤CuCl时的溶解损失并防止其水解氧化,
所以答案是:漏斗、烧杯、玻璃棒; 减小洗涤CuCl时的溶解损失并防止其水解氧化;(iv)CuCl是共价化合物,经测定其蒸气对H2的相对密度为99.5,则其相对分子质量为199,结合实验室为CuCl计算(CuCl)n=199,n=2得到化学式Cu2Cl2 ,
所以答案是:Cu2Cl2 .


科目:高中化学 来源: 题型:
【题目】下列物质或离子在指定分散系中能大量共存的是( )
A.Ca(ClO)2溶液中:K+、Na+、NO3-、Cl-
B.Fe(OH)3胶体中:Na+、H+、Cl-、I-
C.空气中:H2、HCl、NO、NH3
D.无色透明溶液中:K+、Na+、MnO4-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( ) 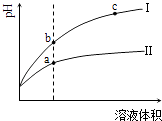
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2)是工业上常用的脱硫剂.为了测定ag Mg3N2样品中Mg3N2的纯度,某同学设计了如图装置(样品中的杂质不与水反应,夹持装置已略去). 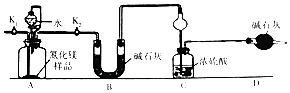
(1)装置A中发生反应的化学方程式为
(2)装置C中球形干燥管的作用是
(3)组装好实验装置后,首先应 , 再加入实验药品,打开(填“K1”或“K2”,后同),关闭 , 打开分液漏斗活塞,加入水,至不再产生气体.打开所有止水夹后通入氮气一段时间,测量装置(填“B”“C”或“D”)反应前后的质量变化为bg,通入氮气的目的是;
(4)Mg3N2的纯度是(用含a、b的式子表示)
(5)若去掉装置D,则导致测定结果(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A.Na+、Fe3+、K+、ClO﹣ 都可在该物质的溶液中大量共存
B.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
C.向0.1molL﹣1该物质的溶液中逐滴滴加0.1molL﹣1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如上图所示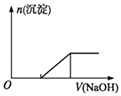
D.向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+2Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是
A. 乙醇与钠反应生成乙醇钠B. 乙烯燃烧生成二氧化碳和水
C. 乙醇与乙酸反应生成乙酸乙酯D. 乙醇与氧气反应生成乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2 , 在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图: 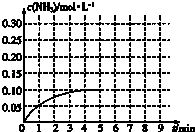
(1)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 .
①0.20molL﹣1 ②0.12molL﹣1 ③0.10molL﹣1 ④0.08molL﹣1
(2)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25molL﹣1),请在如图中画出第5分钟末达到此平衡时NH3浓度的变化曲线 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如今人们把食品分为绿色食品、蓝色食品、白色食品等类型.绿色植物通过光合作用转化的食品叫绿色食品;而直接从海洋获取的食品叫蓝色食品;通过微生物发酵制得的食品叫白色食品.下面属于白色食品的是( )
A.海带
B.食盐
C.面粉
D.酸奶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com