
【题目】(1)氯碱工业是以惰性电极电解饱和食盐水,制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
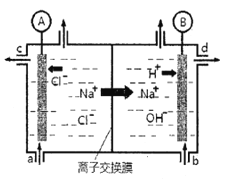
完成下列填空:
①写出电解饱和食盐水的离子方程式_________。
②离子交换膜的作用为:__________、__________。
③氢氧化钠溶液从图中_____位置流出。(选填a、b、c或d)
(2)已知在强碱性环境中,Fe(OH)3可与KClO溶液作用而生成FeO42-。
①此反应的离子方程式是_________。
②高铁电池是一种新型的充电电池,总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,放电时每转移6mol电子,有_____mol K2FeO4被还原,放电时负极附近溶液的pH_________ (填增大”、“减小”或“不变”); 充电时阳极反应式为:_____。
3Zn(OH)2+2Fe(OH)3+4KOH,放电时每转移6mol电子,有_____mol K2FeO4被还原,放电时负极附近溶液的pH_________ (填增大”、“减小”或“不变”); 充电时阳极反应式为:_____。
【答案】 2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 阻止OH-进入阳极室,与Cl2发生副反应 阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸 d 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O 2 减小 Fe(OH)3+5OH--3e-=FeO42-+4H2O
Cl2↑+H2↑+2OH- 阻止OH-进入阳极室,与Cl2发生副反应 阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸 d 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O 2 减小 Fe(OH)3+5OH--3e-=FeO42-+4H2O
【解析】(1)①电解饱和食盐水的反应为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,对应的离子方程式为:2Cl-+2H2O
Cl2↑+H2↑+2NaOH,对应的离子方程式为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
②使用阳离子交换膜进行电解,主要是为了解决两个问题:1、电解生成氢气和氯气,两种气体接触可能会发生爆炸;2、随着电解的进行,溶液显碱性,而电解生成的氯气如果和碱接触就会发生反应。因此,答案为:阻止OH-进入阳极室,与Cl2发生副反应;阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。
③阴极上水电离的氢离子得电子转化为氢气,剩余水电离的氢氧根离子,同时阳极的钠离子穿过阳离子交换膜进入阴极,所以在阴极得到大量的氢氧化钠,所以氢氧化钠从d口流出。
(2)①强碱性环境中,Fe(OH)3可与KClO溶液作用而生成FeO42-,同时KClO化合价降低,一定转化为KCl。碱性条件,反应物中应该有氢氧根离子,根据化合价升降相等、电荷守恒和原子个数守恒得到方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。
②高铁电池是一种新型的充电电池,总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,所以负极一定是单质锌失电子,因为总反应得到氢氧化锌,所以负极反应为:Zn-2e- + 2OH- = Zn(OH)2,总反应减去负极反应得到正极反应:FeO42-+4H2O+3e-= Fe(OH)3+5OH-。由上,放电时每转移6mol电子,根据正极反应得到有2mol K2FeO4被还原;根据负极反应,放电时负极消耗氢氧根离子,所以pH减小;将放电的正极反应倒过来就是充电的阳极:Fe(OH)3+5OH--3e-=FeO42-+4H2O。
3Zn(OH)2+2Fe(OH)3+4KOH,所以负极一定是单质锌失电子,因为总反应得到氢氧化锌,所以负极反应为:Zn-2e- + 2OH- = Zn(OH)2,总反应减去负极反应得到正极反应:FeO42-+4H2O+3e-= Fe(OH)3+5OH-。由上,放电时每转移6mol电子,根据正极反应得到有2mol K2FeO4被还原;根据负极反应,放电时负极消耗氢氧根离子,所以pH减小;将放电的正极反应倒过来就是充电的阳极:Fe(OH)3+5OH--3e-=FeO42-+4H2O。


科目:高中化学 来源: 题型:
【题目】已知:锂离子电池的总反应为:LixC+Li1-xCoO2![]() C+LiCoO2锂硫电池的总反应为:2Li+S
C+LiCoO2锂硫电池的总反应为:2Li+S![]() Li2S。有关上述两种电池说法正确的是
Li2S。有关上述两种电池说法正确的是
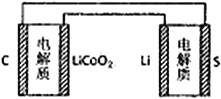
A. 锂离子电池放电时,Li+向负极迁移 B. 锂硫电池充电时,锂电极发生还原反应
C. 理论上两种电池的比能量相同 D. 右图表示用锂离子电池给锂硫电池充电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: CH3COOH 的酸性强于H2CO3。
(1)请写出H2CO3的电离方程式_____________________________。
(2)请写出CH3COONa 的水解离子方程式_____________________________。
(3)浓度均为0.1mol/L的CH3COONa 溶液和Na2CO3溶液,pH 前者_______后者(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在250mL某硫酸盐溶液中,含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属离子。取此溶液20mL,用水稀释至100 mL,稀释后该硫酸盐的物质的量浓度为
A.2 mol·L﹣1 B.0.4 mol·L﹣1 C.0.8 mol·L﹣1 D.1.2mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)ΔH=-1648kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式为_______.
(2)某温度时水的离子积Kw=1.0×10-13,则该温度时纯水的pH____7(填“>”、“<”或“=”)。该温度下,pH=2的CH3COOH溶液中,c(OH-)=_________。
(3)向2份0.1mol/LCH3COONa溶液中分别加人少量NH4NO3、Na2SO3固体(忽略体积变化),则CH3COO-浓度的变化依次为_____、______ (填“减小”“增大”或“不变”)。
(4)同浓度的NaA和NaB两种溶液pH前者大于后者,比较两份溶液中所含阴阳离子总浓度大小, NaA_______NaB (填">”、“<”或“=")。
(5)25℃时,某溶液中Fe3+的浓度为0.010mol/L,使Fe3+沉淀完全的pH为____。(Ksp[Fe(OH)3]=4×10-38,1g2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色酸性溶液中能大量共存的一组离子是
A.Na+、K+、HCO3-、NO3-B.Mg2+、SO42-、Al3+、NO3-
C.Na+、K+、 NO3-、AlO2-D.K+、MnO4-、CH3COO-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中可逆反应 mA(g)+nB(g)![]() pC(g)+qQ(g)m、n、p、q为任意整数时,达到平衡的标志是
pC(g)+qQ(g)m、n、p、q为任意整数时,达到平衡的标志是
①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变 ⑤反应速率v(A)∶v(B)∶v(C)∶v(Q)=m∶n∶p∶q ⑥单位时间内m mol A断键反应,同时p mol C也断键反应
A. ③④⑤⑥ B. ①③④⑤ C. ②③④⑥ D. ①③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A. 标准状况下,22.4L H2含有的原子数为NA B. 等质量的O2和O3中所含的氧原子数相等
C. 常温常压下,14g N2含有原子数为2NA D. 28g CO与22.4L CO2所含的碳原子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com