
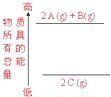
 下列说法正确的是( )
下列说法正确的是( )| A、①③⑥ | B、②④⑤ |
| C、①③④ | D、③⑤⑥ |
| n |
| V |


科目:高中化学 来源: 题型:
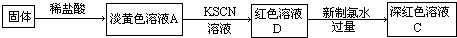
| 实验操作 | 预期现象 | 结论 |
| 取少量褪色后的溶液, | 说明假设一是合理的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、某溶液
| ||
B、某溶液
| ||
C、某溶液
| ||
D、某溶液
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、外电路中,电子由银电极流向铜电极 |
| B、取出盐桥后,电流计的指针仍发生偏转 |
| C、原电池的总反应式为Cu+2AgNO3═2Ag+Cu(NO3)2 |
| D、外电路中每通过0.1mol电子,铜的质量理论上减小6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和热一定是强酸跟强碱反应放出的热量 |
| B、1 mol酸与1 mol碱完全反应放出的热量是中和热 |
| C、在稀溶液中,酸与碱发生中和反应生成1 mol H2O(L)时的反应热叫做中和热 |
| D、表示中和热的离子方程式为:H++OH-═H2O△H=-57.3 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com