
【题目】A是天然气的主要成分,以A为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知烃B在标准状况下的密度为1.16 g L-1,C能发生银镜反应,F为有浓郁香味,不易溶于水的油状
液体。

请回答:
(1)有机物D中含有的官能团名称是_________,C→D的反应类型___________;
(2)有机物A在髙温下转化为B的化学方程式是_____________;
(3)有机物C→E的化学方程式___________________;
(4)下列说法正确的是________;
A.其它条件相同时,D与金属钠反应比水与金属钠反应要剧烈
B.可用饱和Na2CO3溶液鉴别D、E、F
C.A、B、C均难溶于水,D、E、F常温常压下均为液体
D.有机物C能被新制碱性氢氧化铜悬浊液或酸性KMnO4溶液氧化
(5)写出一种与C互为同分异构体的有机物的结构简式_____________。
【答案】 羟基 加成反应或还原反应 2CH4 ![]() CH≡CH+3H2 2CH3CHO + O2
CH≡CH+3H2 2CH3CHO + O2 ![]() 2CH3COOH BD CH2=CHOH或
2CH3COOH BD CH2=CHOH或 ![]()
【解析】本题考查有机物的推断,A为天然气的主要成分,即A为CH4,B在标准状况下的密度为1.16g·L-1,根据M=22.4ρ=22.4×1.16g·mol-1=26g·mol-1,即B为C2H2,C能发生银镜反应,说明C属于醛基,即为乙醛,CH3CHO与氢气发生还原反应或加成反应,生成CH3CH2OH,乙醛被氧气氧化成CH3COOH,乙酸与乙醇发生酯化反应生成CH3COOCH2CH3,(1)根据上述分析,D为CH3CH2OH,含有的官能团是羟基,乙醛生成乙醇,是还原反应或加成反应;(2)根据原子守恒,应是2个甲烷分子生成1个乙炔分子,同时产生1个氢气分子,即反应方程式为:2CH4 ![]() CH≡CH+3H2;(3)根据上述分析,此反应为乙醛的氧化反应,即反应方程式为:2CH3CHO + O2
CH≡CH+3H2;(3)根据上述分析,此反应为乙醛的氧化反应,即反应方程式为:2CH3CHO + O2 ![]() 2CH3COOH;(4)A、D为乙醇,电离出的H+能力弱于水,因此金属钠与乙醇反应比与水反应缓慢,故A错误;B、乙醇与碳酸钠互溶,乙酸与碳酸钠反应产生CO2气体,乙酸乙酯不溶于碳酸钠,浮在碳酸钠的液面上,出现分层,因此可以鉴别,故B正确;C、甲烷和乙炔不溶于水,乙醛溶于水,故C错误;D、C为乙醛,能被新制氢氧化铜悬浊液氧化,也能被酸性高锰酸钾溶液氧化,故D正确;(5)与乙醛互为同分异构体的是 CH2=CHOH或
2CH3COOH;(4)A、D为乙醇,电离出的H+能力弱于水,因此金属钠与乙醇反应比与水反应缓慢,故A错误;B、乙醇与碳酸钠互溶,乙酸与碳酸钠反应产生CO2气体,乙酸乙酯不溶于碳酸钠,浮在碳酸钠的液面上,出现分层,因此可以鉴别,故B正确;C、甲烷和乙炔不溶于水,乙醛溶于水,故C错误;D、C为乙醛,能被新制氢氧化铜悬浊液氧化,也能被酸性高锰酸钾溶液氧化,故D正确;(5)与乙醛互为同分异构体的是 CH2=CHOH或 ![]() 。
。


科目:高中化学 来源: 题型:
【题目】可逆反应N2+3H2![]() 2NH3是工业上合成氨的重要反应。
2NH3是工业上合成氨的重要反应。

(1)根据图1请写出合成氨的热化学方程式_________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的________条件,该条件的改变与图2中哪一时刻条件的改变相同___________(用“t1……t6”表示)。
(3)t3时刻改变的条件是___________,t5时刻改变的条件是___________。
(4)某温度下,若把10 mol N2与30 molH2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则氮气的转化率____________。
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 molN2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;B中NH3的体积分数为b,放出热量Q2kJ。则:a__________b (填“>”、“<”或“=”,下同),Q1___________Q2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示温度和压强对平衡状态下可逆反应2M(g)+N(g)![]() 2Q(g)ΔH<0的影响。下列有关说法正确的是(反应容器的体积不变)
2Q(g)ΔH<0的影响。下列有关说法正确的是(反应容器的体积不变)
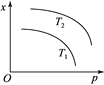
A. x可能表示该反应的平衡常数
B. x可能表示平衡混合物的密度
C. 当x表示Q的体积分数时,T2<T1
D. 当x表示平衡混合物的物质的量时,T2<T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能大量共存于同一溶液中的离子组是( )
A.Ba2+、K+、SO42— B.Ca2+、NO3—、Cl—
C.Na+、Mg2+、OH— D.H+、Cl—、HCO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、 Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式____________。
(2)TiCl4熔点是-25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4-中B原子的杂化类型为____________;
(3)在 TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO-互为等电子体的分子化学式为_________________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色),两者配位数_____(填“相同”或“不同”),绿色晶体中配体是______。

(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为____________。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为![]() g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
g/cm3,阿伏加德罗常数为NA,则该晶胞的边长为______________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是中学化学实验室的常见药品,回答下列实验问题。
Ⅰ.配制一定物质的量浓度的硫酸溶液:
(1)某次实验大约需要1mol/L硫酸溶液435ml。同学们发现实验室内没有450ml的容量瓶,某同学提议用1个200ml容量瓶和1个250ml容量瓶来配制,你认为该提议_________(填“合理”、“不合理”)。
(2)实验中要配制0.5mol/L H2SO4溶液250ml。则需量取密度为1.84g/ml、98%的浓硫酸________ml。
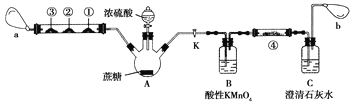
Ⅱ.蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体,会对环境造成污染。某实验小组利用如下装置对该实验进行改进。回答下列问题:
注:硬质玻璃管中①、②、③处分别为滴有Na2S溶液的滤纸、滴有品红溶液的滤纸、滴有酸性KMnO4溶液的滤纸,a和b分别为两个小气球。
(1)图中盛装浓硫酸的仪器名称为________________。
(2)实验开始后先关闭活塞K,硬质玻璃管中①号试纸变黄,②号和③号滤纸均褪色,a处气球变大。硬质玻璃管中实验现象说明炭化实验产生的刺激性气味气体是SO2,①、②、③处发生的变化分别说明SO2具有_____________、_____________和_____________(填SO2表现出的性质)。
(3)打开活塞K,a处气球变小,b处气球变大。使三颈烧瓶内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊。为证明有CO2生成,可以在④号位置的滤纸滴加______________溶液,该试剂的作用是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛矿工业中会排放出酸性废水。含石TiO2+、Fe2+、Fe3+离子,其综合利用如下:

已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)写出步骤Ⅰ发生反应的离子方程式___________。
(2)步骤Ⅰ后所得溶液中Fe2+的检验方法是___________。
(3)从溶液中得到FeSO4·7H2O的操作是___________、___________、过滤、洗涤。步骤Ⅲ中反应温度一般需控制在35℃以下,其目的是___________。
(4)步骤Ⅳ发生反应的化学方程式为___________。
(5)步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5,c(Fe2+)=1×10-6mol·L-1。试判断所得的FeCO3中___________(填“有”或“没有”)(己知Fe(OH)2(已知Fe(OH)2的Ksp为8×10-16)
(6)向“富TiO2+溶液”中加入Na2CO3粉末得到固体TiO2·nH2O。请用化学原理解释其原因。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推论正确的是
A. NH![]() 为正四面体结构,可推测PH
为正四面体结构,可推测PH![]() 也为正四面体结构
也为正四面体结构
B. SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
C. CO2为非极性分子,可推测SO2也为非极性分子
D. C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com