
| A、25℃1 L pH=13的Na2CO3溶液中,Na+数目为0.2NA |
| B、2g D2O中,含中子总数为NA |
| C、将H2O2溶液与酸性KMnO4溶液作用,若有1 molO2生成,转移电子数为4NA |
| D、标准状况下,22.4L甲苯中含有C-H键数目为8 NA |


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y分子式中氢原子数一定相同,与碳原子数的多少无关 |
| B、若X为CH4,则相对分子质量最小的Y是甲醇 |
| C、若X为CH4,则相对分子质量最小的Y是乙二醇 |
| D、X、Y的分子式应含有相同的氢原子数,且相差n个碳原子,同时相差2n个氧原子(n为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24LHCl溶于水,溶液中H+数为NA |
| B、100g98%的浓硫酸中含氧原子个数为4NA |
| C、2.3gNa和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA |
| D、1molFeCl3跟水完全反应转化为氢氧化铁胶体,其中胶体粒子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 mol/L的Fe(NO3)2溶液:H+、Na+、SCN-、S2- |
| B、c(OH-)/c(H+)=1013的溶液Mg2+、NH4+、MnO4-、Cl- |
| C、pH=l的溶液:K+、NH4+、NO3-、Cl- |
| D、能溶解Al2O3的溶液:Na+、K+、HCO3-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将0.050mol SO2和0.030mol O2放入容积为1L的密闭容器中,在一定条件下发生如下反应:2SO2(g)+O2(g)?2SO3(g),△H=-196.64kJ/mol.
将0.050mol SO2和0.030mol O2放入容积为1L的密闭容器中,在一定条件下发生如下反应:2SO2(g)+O2(g)?2SO3(g),△H=-196.64kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:

 ,则E的结构简式为
,则E的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
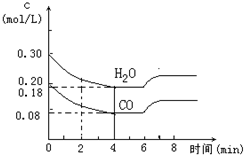
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com