
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1.0L1.0mol·L-1的NaAlO2溶液中含有的氧原子数为2NA
B. 2.4g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C. 标准状况下,3.36LC2H4和C3H6的混合气体中含有碳碳双键的数目为0.15 NA
D. 用生氢剂CaH2与水反应制氢时,生成1molH2时转移电子数目为2 NA
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2016-2017学年黑龙江省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列类比关系正确的是( )
A. Al与浓盐酸反应放出H2,则与浓硫酸反应也放出H2
B. Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应
C. Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3
D. Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2
查看答案和解析>>
科目:高中化学 来源:辽宁省大连市2017届高三3月双基测试化学试卷 题型:选择题
下表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=2×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9 :5,此时溶液pH=5
C. 碳酸钠溶液中滴加少量氯水的离子方程式是2CO32-+Cl2+H2O=2HCO3-+Cl-+ClO-
D. 向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO42-先形成沉淀
查看答案和解析>>
科目:高中化学 来源:辽宁省大连市2017届高三3月双基测试化学试卷 题型:选择题
下列关于有机化合物的说法正确的是
A. 聚氯乙烯分子中含有碳碳双键
B. 油脂的皂化反应属于加成反应
C. 糖类物质均可直接食用并能被人体吸收
D. 以淀粉为原料可制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三下学期第一次月考理科综合化学试卷(解析版) 题型:选择题
常温下,向10mL0.1mol·L-1的HR溶液中逐渐滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电能力变化如图。下列分析不正确的是

A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7,此时酸碱恰好中和
C. b、c两点水的电离程度:b<c
D. c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2017届贵州省贵阳市高三2月适应性考试(一)理综化学试卷(解析版) 题型:填空题
氮氧化物(NOx)是大气主要污染物之一,请根据以下方法的选用回答相应问题:
I.利用CH4催化还原氮氧化物消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(l) △H=-662kJ/mol
4NO(g)+CO2(g)+2H2O(l) △H=-662kJ/mol
②CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
其中①式的平衡常数为K1,②式的平衡常数为K2,则:(1) CH4 (g)+4NO (g)=2N2(g) + CO2 (g )+H2O (1)△H=_________ ;改反应的平衡常数K=_________(用含Kl、K2的代数式表示)。
II利用燃料电池的原理来处理氮氧化物是一种新方向。装置如图所示,在处理过程中石墨电极I上反应生成一种氧化物Y。

(2)写出氧化物Y的化学式_____________;
(3)石墨II电极为______(填“正”或“负”)极,该电极反应为______________;
Ⅲ.利用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g) N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
N2(g)+ CO2(g) △H=akJ/mol。某研究小组向某恒容密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,已知在不同时间测得各物质的浓度如下:
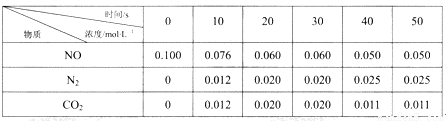
(4)该反应的平衡常数表达式K=_______,在0~10s内,N2的平均反应速率为______mol/(L·s),NO的转化率为________;
(5)30s后,改变某一条件,反应重新达到平衡,则改变的条件可能是________,若30s后升高温度至T2℃,平衡时,容器中NO的浓度由0.060mol/L变为0.072mol/L,则该反应的a___0 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省贵阳市高三2月适应性考试(一)理综化学试卷(解析版) 题型:选择题
下列关于有机化合物的说法正确的是
A. 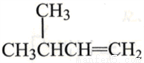 的名称为:2-甲基-3-丁烯
的名称为:2-甲基-3-丁烯
B. HOCH2COOH 缩聚产物的结构简式为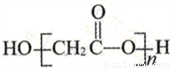
C. 甲烷、苯均不能使酸性高锰酸钾溶液褪色,但二者都具有还原性
D. 乙酸分子中不含醛基,所以不能与新制的Cu(OH)2悬浊液反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省长沙市高二上学期期末考试化学试卷(解析版) 题型:填空题
(1)肼(N2H4)是火箭推进器中常用的高能燃料,已知0.4 mol液态肼和足量H2O2反应,生成N2和水蒸气,放出256. 65kJ的热量,请写出该反应的热化学方程式:__________。
(2)工业上制氢气的一个重要反应是:CO(g) +H2O(g)=CO2(g)+H2(g)
已知在25℃时:C(石墨)+ O2(g)=CO(g) △H1=-111kJ·mol-1
O2(g)=CO(g) △H1=-111kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H2=-242 kJ·mol-1
O2(g)=H2O(g) △H2=-242 kJ·mol-1
C(石墨)+O2(g)=CO2(g) △H3=-394kJ·mol-1
试计算25℃时一氧化碳与水作用转化为氢气和二氧化碳反应的反应热△H=______kJ·mol-1
(3)CO2再在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与NaCO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol / L ,则生成沉淀所需CaCl2溶液的最小浓度为__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省台州市高一上学期期末质量评估考试化学试卷(解析版) 题型:选择题
亚硝酸钠(NaNO2)俗称“工业盐”,其外观与食盐相似,有咸味,有毒,可用做食品防腐剂和肉类食品的发色剂。已知亚硝酸钠能与氢碘酸(HI,具有强酸性)发生如下反应:4HI+2NaNO2=2NaI+I2+2NO↑+2H2O。下列说法正确的是
A. 亚硝酸钠具有氧化性,不可能表现出还原性
B. 该反应中氧化剂与还原剂的物质的量之比为1:1
C. 向反应所得的混合溶液中加入稀硫酸和亚硝酸钠,I-不可能转化为I2
D. 人误食亚硝酸钠中毒时,可服用氢碘酸解毒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com