
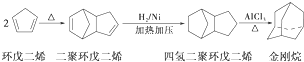
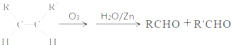 .请写出下列反应产物的结构简式:
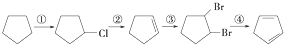
.请写出下列反应产物的结构简式: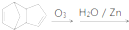
| 2×10+2-12 |
| 2 |
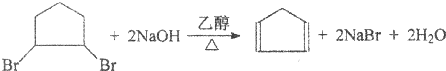 ,
, ;
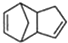
;
| O3 |
| H2O/Zn |
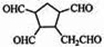 ,故答案为:
,故答案为: .
.| 2×10+2-12 |
| 2 |
 ,故答案为:
,故答案为: .
.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
| A、纯净物与混合物:是否仅含有同种元素 |
| B、电解质与非电解质:溶液的导电能力大小 |
| C、溶液与胶体:本质不同的原因是能否发生丁达尔现象 |
| D、氧化还原反应:元素化合价是否变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数编号 | 待 待测盐酸体积(mL) | 滴入Na2CO3 溶液体积(mL) |
| 1 | 20.00 | 19.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2O |
| △ |

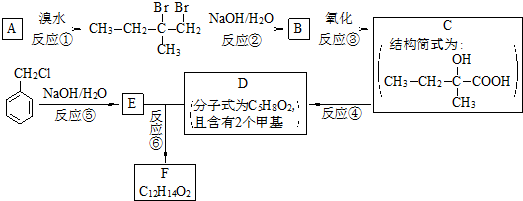
查看答案和解析>>
科目:高中化学 来源: 题型:
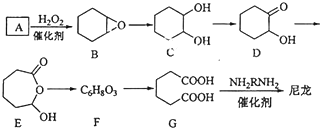
查看答案和解析>>
科目:高中化学 来源: 题型:
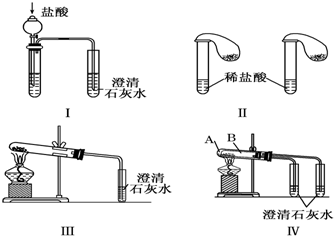
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C、向水中加入少量固体Na,平衡正向移动,c(H+)降低 |
| D、将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
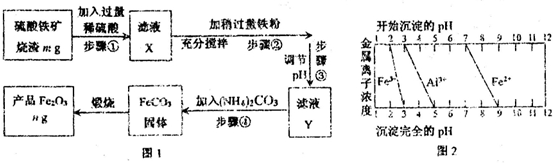
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com