
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
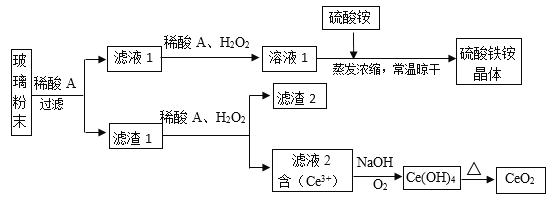
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________________。
(2)滤液1中加入H2O2溶液的目的是________________________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂为________________。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式___________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式_____________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:______________________________,相对于去除中性废水,其在去除酸性废水中的悬浮物时效率_________(填“增强”或“降低”)。
【答案】 H2SO4 使Fe2+氧化为Fe3+ 铁氰化钾溶液(或高锰酸钾溶液) Fe2+ +2FeO(OH)=Fe3O4 +2H+ 4Ce 3 ++ O2 +12OH-+2H2O ==4 Ce(OH)4↓ Fe3++3H2O![]() Fe(OH)3+3H+ 降低
Fe(OH)3+3H+ 降低
【解析】由已知结合流程,玻璃粉末加稀酸A后,所得滤液1含有Fe2+、Fe3+,滤渣1为H2SiO3和CeO2;滤渣1中的CeO2与稀酸A和H2O2反应生成滤液2(含Ce3+),滤渣2为不反应的H2SiO3;滤液2经过一系列反应生成CeO2;滤液1在酸性条件下与H2O2反应,将Fe2+氧化为Fe3+,所得溶液1与硫酸铵经过一系列变化得到硫酸铁铵晶体。
(1)因为流程中最后得到硫酸铁铵晶体,所以稀酸A应为:H2SO4。
(2)由上述分析知,滤液1中加入H2O2溶液的目的是:使Fe2+氧化为Fe3+。
(3)因为滤液1中含有Fe3+,所以要证明滤液1中含有Fe2+,可用铁氰化钾溶液(或高锰酸钾溶液)。
(4)已知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,根据原子守恒和离子守恒,还生成H+,该反应的离子方程式为:Fe2+ +2FeO(OH)=Fe3O4 +2H+。
(5)滤液2含有Ce3 +,在碱性条件下被O2氧化成Ce(OH)4,离子方程式为:4Ce3 ++ O2 +12OH-+2H2O =4 Ce(OH)4↓。
(6)硫酸铁铵晶体净水原理是溶解后溶液中的铁离子水解生成氢氧化铁胶体,胶体具有吸附悬浮杂质的作用,可以净水,反应的离子方程式为:Fe3++3H2O![]() Fe(OH)3+3H+;因为酸性溶液会抑制Fe3+水解,所以相对于去除中性废水,其在去除酸性废水中的悬浮物时效率会降低。
Fe(OH)3+3H+;因为酸性溶液会抑制Fe3+水解,所以相对于去除中性废水,其在去除酸性废水中的悬浮物时效率会降低。


科目:高中化学 来源: 题型:
【题目】为了探究“二氧化碳是否在有水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如下图的实验装置,分别进行了甲、乙两次实验:
实验甲:干燥的二氧化碳和过氧化钠的反应。在干燥的试管Ⅱ中装入Na2O2,在通入CO2之前,关闭K1和K2。在试管Ⅰ内装入试剂X后,打开K1和K2,通入CO2,几分钟后,将带火星的木条插入试管Ⅲ的液面上,观察到木条不复燃,且Ⅱ中的淡黄色没有变化。
实验乙:潮湿的二氧化碳和过氧化钠的反应。在试管Ⅰ内装入试剂Y,其他操作同实验甲,观察到木条复燃,且Ⅱ中的淡黄色变为白色。
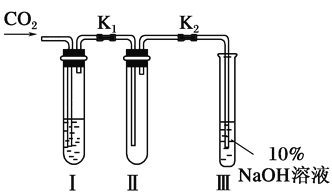
试回答下列问题:
(1)在装入Na2O2后,通入CO2前,关闭K1和K2的目的是_________________________________________________________。
(2)在实验甲中,试剂X是______________;在实验乙中,试剂Y是_____________。
(3)根据上述两个实验现象,得到的结论是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是中学实验室常用的试剂,可以用来制备氢氧化铁胶体。
(1)下列制备氢氧化铁胶体的操作方法正确的是____________(填字母);
A.向饱和氯化铁溶液中滴加少量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至液体呈红褐色
(2)写出制备氢氧化铁胶体的离子方程式_______________;
(3)下列与胶体性质无关的是_____________(填字母);
A.河流入海口处形成沙洲
B.使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
D.在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀
E.冶金厂常用高压电除去烟尘
(4)从溶液中分离提纯Fe(OH)3胶体的方法叫_____________;
(5)向氢氧化铁胶体中逐滴加入稀硫酸至过量的现象是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】二氧化碳是一种宝贵的碳氧资源。以CO2和NH3为原料合成尿素是固定和利用CO2
的成功范例。在尿素合成塔中的主要反应可表示如下:
反应 I:2NH3(g)+CO2(g) ![]() NH2COONH4(s) ΔH1=-159.47 kJ·mol-1
NH2COONH4(s) ΔH1=-159.47 kJ·mol-1
反应II:NH2COONH4(s) ![]() CO(NH2)2(s)+H2O(g) ΔH2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.49kJ·mol-1
请回答下列问题:
(l)写出CO2和NH3为原料生成尿素和气态水的热化学反应方程式_______,反应II自发进行的条件是_____。
(2)CO2和NH3为原料合成尿素的反应中影响CO2转化率的因素很多,下图为某待定条件下,不同水碳比[n(H2O)/n(CO2)]和温度影响CO2转化率变化的趋勢曲线。
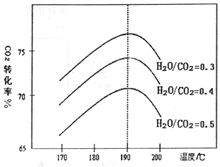
下列说法不正确的是__________。
A.温度升髙该反应平衡常数逐渐减小,移走部分尿素平衡向正方向移动
B.当温度低于190℃,随温度升髙CO2转化率逐渐增大,其原因可能是温度升高平衡向正方向移动
C.当温度髙于190℃后,随温度升髙CO2转化率逐渐减小,其原因可能是温度升高发生了副反应
D.其他条件相同时,为提髙CO2的转化率,生产中可以采取的措施是提高水碳比
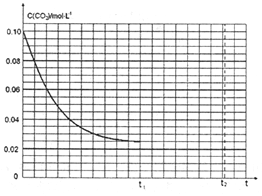
(3)某研究小组为探究反应I中影响C(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡,其c(CO2)随时间t变化趋势曲线如下图所示。则其逆反应的平衡常数为_____。若其他条件不变,t1时将容器体积压缩到1L,请画出t1t2时间段C(CO2)随时间t变化趋势曲线(t2时达到新的平衡)。__________
(4)电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如下图,请写出在A电极上发生的电极反应式_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g)在不同情况下的反应速率,其中的反应速率最快的是
2C(g)+2D(g)在不同情况下的反应速率,其中的反应速率最快的是
A. v(A)=0.20 mol/(L·s) B. v(B)=0.30 mol/(L·s)
C. v(C)=0.50 mol/(L·s) D. v(D)=0.60 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度,相同物质的量浓度的4种溶液( )
①CH3COONa ②NaHSO4 ③NaCl ④Na2CO3
按pH由大到小的顺序排列,正确的是
A.④>①>③>②B.①>④>③>②
C.①>②>③>④D.④>③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3﹣>I﹣,氧化性IO3﹣>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.
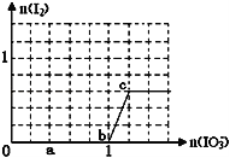
(1)a点时消耗NaHSO3的物质的量为_____mol,假设反应中无SO2逸出。
(2)从b点开始计算,当生成0.3mol I2时,转移电子数为_______个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的转化通过一步反应不能实现的是( )
A.HCl →Cl2→HClO→NaClO
B.Na→Na2O2→Na2CO3→NaHCO3
C.Si→SiO2→H2SiO3→Na2SiO3
D.Al→NaAlO2 →Al(OH)3→Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向KBr和KI的混合溶液中通入足量的氯气后,再将溶液蒸干灼烧,最后剩余的固体物质是( )
A. KCl和KBr B. KCl C. KCl和I2 D. KCl和KI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com