
分析 根据Ag+以AgSCN白色沉淀的形式析出,据此计算出溶液中剩余的AgNO3的物质的量,AgNO3的总量减去剩余的AgNO3的量,即为Cl-反应的Ag+的物质的量,据此进行分析.
解答 解:AgNO3 +NH4SCN=AgSCN↓+NH4NO3
1 1
C(AgNO3)×20.00ml C(NH4SCN)×21.00ml
则:C(AgNO3)×20=C(NH4SCN)×21①
n(NaCl)=$\frac{0.1173g}{23g/mol}$=0.0051mol
AgNO3+NaCl=AgCl↓+NaNO3
1 1
0.0051 0.0051
则:n消(AgNO3)=0.0051mol
故C(AgNO3)×30.00×10-3L=n消(AgNO3)+C(AgNO3)×3.20×10-3L,即C(AgNO3)×30.00×10-3L=0.0051mol+C(AgNO3)×3.20×10-3L,
故C(AgNO3)=0.1903mol/L②,将②代入①得,C(NH4SCN)=0.1812mol/L.
答:AgNO3和NH4SCN溶液的浓度,分别为0.1903mol/L和0.1812mol/L.
点评 本题考查滴定原理过程中涉及的计算,注意把握信息与所学方程式的应用,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$\stackrel{浓硝酸}{→}$Cu(NO3)2 | B. | Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | D. | Cu$→_{△}^{浓硫酸}$CuSO4$\stackrel{硝酸钡}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
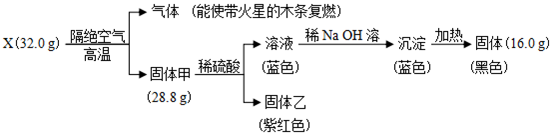
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温,0.1mol•L-1的CH3COOH溶液中:c(CH3COOH)<c(CH3COO-) | |
| B. | 1L 0.1mol•L-1的(NH4)2Fe(SO4)2溶液中:c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | 室温,0.1mol•L-1的CH3COONa、NaOH和Na2CO3三种溶液,pH大小的顺序为:NaOH<CH3COONa<Na2CO3 | |
| D. | 向0.01mol•L-1的NaHSO4溶液中滴加NaOH溶液至中性时:c(SO${\;}_{4}^{2-}$)>c(Na+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
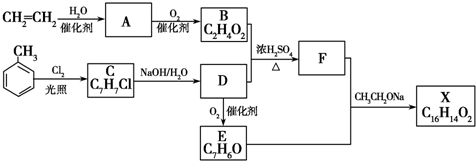
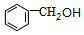 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.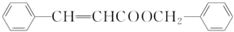 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,如图为病人输液用的葡萄糖(化学式为C6H12O6)注射液标签上的部分內容(该注射液就是葡萄糖的水溶液).试根据标签上的有关数据回答下列问题:
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,如图为病人输液用的葡萄糖(化学式为C6H12O6)注射液标签上的部分內容(该注射液就是葡萄糖的水溶液).试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
(1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com