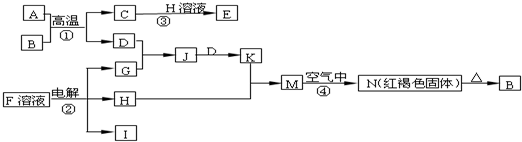
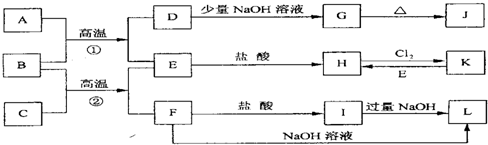
解:反应①常被应用于野外焊接钢轨,应为金属铝和氧化铁发生铝热反应,方程式为:Fe
2O
3+2Al

2Fe+Al
2O
3,则A为Al,B为Fe
2O
3,G为黄绿色气体,应为Cl
2,F是海水中含有盐的主要成分,应为NaCl,电解生成NaOH、H
2和Cl
2,N为红褐色固体,应为Fe(OH)
3,则D应为Fe,C为Al
2O
3,H为NaOH,G为Cl
2,J为FeCl
3溶液,K为FeCl
2溶液,M为Fe(OH)
2,H为H
2,
(1)由以上分析可知H为NaOH,故答案为:NaOH;
(2)反应②为电解饱和食盐水的反应,工业上称为氯碱工业,故答案为:氯碱;
(3)反应③为Al
2O
3和NaOH的反应,离子方程式为Al
2O
3+2OH
-=2AlO
2-+H
2O,故答案为:Al
2O
3+2OH
-=2AlO
2-+H
2O;
(4)F是海水中含有盐的主要成分,应为NaCl,电解生成NaOH、H
2和Cl
2,反应的方程式为2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑,
故答案为:2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑.
分析:反应①常被应用于野外焊接钢轨,应为金属铝和氧化铁发生铝热反应,方程式为:Fe
2O
3+2Al

2Fe+Al
2O
3,则A为Al,B为Fe
2O
3,G为黄绿色气体,应为Cl
2,F是海水中含有盐的主要成分,应为NaCl,电解生成NaOH、H
2和Cl
2,N为红褐色固体,应为Fe(OH)
3,则D应为Fe,C为Al
2O
3,H为NaOH,G为Cl
2,J为FeCl
3溶液,K为FeCl
2溶液,M为Fe(OH)
2,H为H
2,结合物质的性质解答该题.
点评:本题考查无机物的推断,题目难度较大,本题注意把握物质的反应特征、物质的本身特性以及工业反应为突破口进行推断,明确物质的种类为解答该题的关键.

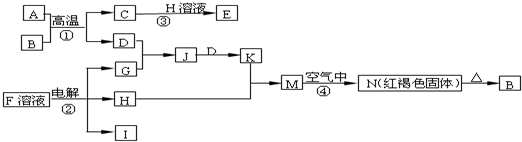
 2Fe+Al2O3,则A为Al,B为Fe2O3,G为黄绿色气体,应为Cl2,F是海水中含有盐的主要成分,应为NaCl,电解生成NaOH、H2和Cl2,N为红褐色固体,应为Fe(OH)3,则D应为Fe,C为Al2O3,H为NaOH,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,H为H2,
2Fe+Al2O3,则A为Al,B为Fe2O3,G为黄绿色气体,应为Cl2,F是海水中含有盐的主要成分,应为NaCl,电解生成NaOH、H2和Cl2,N为红褐色固体,应为Fe(OH)3,则D应为Fe,C为Al2O3,H为NaOH,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,H为H2, 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑, 2NaOH+H2↑+Cl2↑.
2NaOH+H2↑+Cl2↑. 2Fe+Al2O3,则A为Al,B为Fe2O3,G为黄绿色气体,应为Cl2,F是海水中含有盐的主要成分,应为NaCl,电解生成NaOH、H2和Cl2,N为红褐色固体,应为Fe(OH)3,则D应为Fe,C为Al2O3,H为NaOH,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,H为H2,结合物质的性质解答该题.
2Fe+Al2O3,则A为Al,B为Fe2O3,G为黄绿色气体,应为Cl2,F是海水中含有盐的主要成分,应为NaCl,电解生成NaOH、H2和Cl2,N为红褐色固体,应为Fe(OH)3,则D应为Fe,C为Al2O3,H为NaOH,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,H为H2,结合物质的性质解答该题.