
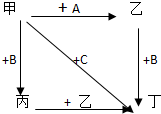
 图中,乙是一种非金属单质,通常为黄绿色气体,A为一种黑色粉状固体,B是一种常见的金属单质,C是一种红褐色物质,它们之间存在如图关系:
图中,乙是一种非金属单质,通常为黄绿色气体,A为一种黑色粉状固体,B是一种常见的金属单质,C是一种红褐色物质,它们之间存在如图关系:分析 乙是一种非金属单质,通常为黄绿色气体,应为Cl2,一般由二氧化锰和浓盐酸反应制备,则甲为浓盐酸,A为一种黑色粉状固体,应为MnO2,B是一种常见的金属单质,由转化关系可知存在变价,应为Fe,C是一种红褐色物质,应为Fe(OH)3,则丙为FeCl2,丁为FeCl3,以此解答该题.
解答 解:乙是一种非金属单质,通常为黄绿色气体,应为Cl2,一般由二氧化锰和浓盐酸反应制备,则甲为浓盐酸,A为一种黑色粉状固体,应为MnO2,B是一种常见的金属单质,由转化关系可知存在变价,应为Fe,C是一种红褐色物质,应为Fe(OH)3,则丙为FeCl2,丁为FeCl3,
(1)由以上分析可知甲为盐酸,乙为氯气,丙为氯化亚铁,丁为氯化铁,故答案为:盐酸;氯气;氯化亚铁;氯化铁;
(2)实验室由二氧化锰和浓盐酸反应制备氯气,反应的化学方程式为MnO2+4HCl $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
(3)由丙到丁的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)氯气和水反应生成盐酸和次氯酸,次氯酸为弱酸,氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-,故答案为:Cl2、H2O、HClO、H+、Cl-、ClO-.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
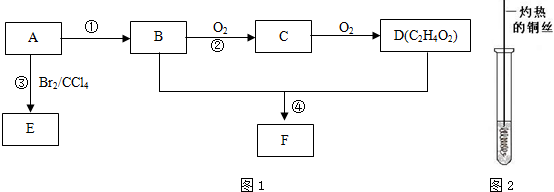
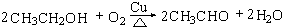 .
. (4)D与碳酸氢钠溶液反应的离子方程式为CH3COOH+HCO3-→CH3COO-+H2O+CO2↑.
(4)D与碳酸氢钠溶液反应的离子方程式为CH3COOH+HCO3-→CH3COO-+H2O+CO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.36 L | B. | 4.48 L | C. | 6.72 L | D. | 8.96 L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| J | ||||
| R |
 ;
;| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com