
| A. | 碳-14核素:${\;}_8^{14}C$ | B. | Ca2+的结构示意图为  | ||
| C. | 氮气的电子式 | D. | HCIO的结构式为H-Cl-O |
分析 A.碳是6号元素;
B.钙离子核外有18个电子;
C.氮气中存在三对共用电子对,为三键;
D.次氯酸中O原子为中心原子,根据共价键成键的特点,氢原子形成一对共用电子对,氧原子形成两对共用电子对,氯原子形成一对共用电子对.
解答 解:A.碳是6号元素,为614C,故A错误;
B.钙离子核外有18个电子,结构示意图为  ,故B正确;
,故B正确;
C.氮气的电子式为 ,故C错误;
,故C错误;
D.因HClO为共价化合物,根据共价键成键的特点,氢原子形成一对共用电子对,氧原子形成两对共用电子对,氯原子形成一对共用电子对,其结构式为H-O-Cl,故D错误.
故选B.
点评 本题考查化学用语,涉及元素符号、电子式、结构式、离子结构示意图等,注意氮气中存在N≡N键为解答的易错点,把握化学用语的规范使用,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物可以分解为PH3和HI或H2和I2 | |
| C. | 这种化合物能跟碱反应 | |
| D. | 该化合物可以由PH3和HI化合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

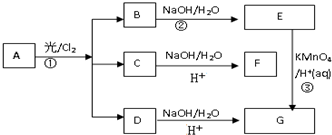
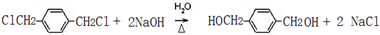 .
.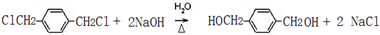 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | 50 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 粉末 | 15 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若aXm+和bYn-两种离子电子层结构相同,则a-b=n-m | |
| B. | 24Mg32S中电子总数与中子总数之比为1:1 | |
| C. | CO2和PC13分子中各原子最外层都满足8电子结构 | |
| D. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④>①>③>② | B. | ④=①>③>② | C. | ①>④>③>② | D. | ①=④>③=② |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com