
(8分)Mn2+离子是KMnO4溶液氧化H2C2O4的催化剂。有人提出该反应的历程为:
Mn(Ⅶ)![]() Mn(Ⅵ)
Mn(Ⅵ)![]() Mn(Ⅳ)
Mn(Ⅳ)![]() Mn(Ⅲ)
Mn(Ⅲ)![]()
Mn(C2O4)n3-2n![]() Mn2++CO2
Mn2++CO2
请设计2个实验方案来验证这个历程是可信的(无须给出实验装置,无须指出选用的具体试剂,只需给出设计思想)。
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:阅读理解
 (2009?三明一模)张明同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
(2009?三明一模)张明同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
| ||
| ||
| ||
| ||
| 实验操作 | 预期现象和结论 |
往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液 往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液 |
若溶液变为红色,说明该固体已变质;若溶液未变红色,说明该固体没有变质 若溶液变为红色,说明该固体已变质;若溶液未变红色,说明该固体没有变质 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
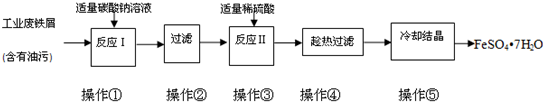
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 某同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
某同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
| ||
 CO2↑+2SO2↑+2H2O)
CO2↑+2SO2↑+2H2O)
| ||
 CO2↑+2SO2↑+2H2O)
CO2↑+2SO2↑+2H2O)| 实验操作 | 预期现象和结论 |

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com