
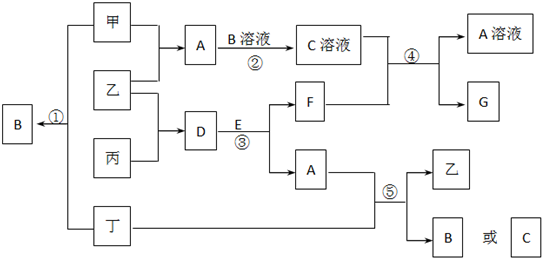
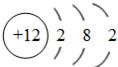 ,A为NH3 ,是共价化合物,电子式为:
,A为NH3 ,是共价化合物,电子式为: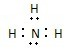 ,A、B的等电子体分别为H3O+、HS-,
,A、B的等电子体分别为H3O+、HS-,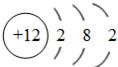 ;
;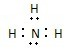 ;H3O+;HS-;
;H3O+;HS-;

 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
| A、乙醇在浓硫酸存在下发生消去反应 |
| B、乙醇与金属钠反应 |
| C、乙醇的酯化反应 |
| D、乙醇在铜丝存在条件下发生催化氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤 | 操 作 | 现 象 |
| (1) | 取少许溶液向其中滴加稀盐酸 | 有气泡产生 |
| (2) | 另取少许溶液向其中滴加氯水,及CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向(2)所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| (4) | 将(3)过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A、肯定含有的离子是③④⑤ |
| B、肯定没有的离子是②⑤ |
| C、可能含有的离子是①⑥ |
| D、不能确定的离子是③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
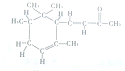
| A、α-鸢尾酮可与某种酚互为同分异构体 |
| B、1mol α-鸢尾酮最多可与2mol H2加成 |
| C、α-鸢尾酮能发生银镜反应 |
D、α-鸢尾酮经加氢→消去反应可转变为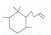 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
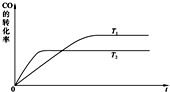 煤间接液化是煤化工的一种重要方法:首先将原料煤与氧气、水蒸汽反应将煤全部气化,制得的粗煤气经变换、脱硫、脱碳制成洁净的合成气(CO+H2),然后合成气在催化剂作用下发生合成反应生成烃类,如:[nCO+(2n+1)H2=CnH2n+2+nH2O];或者合成醇类,如合成甲醇:CO(g)+2H2(g)?CH3OH(g).等等.
煤间接液化是煤化工的一种重要方法:首先将原料煤与氧气、水蒸汽反应将煤全部气化,制得的粗煤气经变换、脱硫、脱碳制成洁净的合成气(CO+H2),然后合成气在催化剂作用下发生合成反应生成烃类,如:[nCO+(2n+1)H2=CnH2n+2+nH2O];或者合成醇类,如合成甲醇:CO(g)+2H2(g)?CH3OH(g).等等.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②③④ |
| C、②③ | D、①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com