
A、△H4=
| ||
B、△H4=
| ||
C、△H4=
| ||
D、△H4=
|
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| B、向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++2OH-+2 HCO3-=CaCO3↓+CO32-+2H2O |
| C、向CuSO4溶液中加入Ba(OH)2溶液,观察到有蓝色沉淀生成:Cu2++2OH-=Cu(OH)2↓ |
| D、FeSO4溶液中加H2O2溶液:Fe2++2H2O2+4H+=Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K(HF)=7.2×10-4 |
| B、K(HNO2)=4.9×10-10 |
| C、HF>HNO2>HCN |
| D、无法判断酸性强弱顺序 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若温度不变,将容器的体积缩小到原来的一半,此时A的浓度变为原来的2.1倍,则m+n<p+q | ||
| B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | ||
| C、若m+n=p+q,则往含有a mol气体的平衡体系中再加入amolB,达到新平衡时,气体的总物质的量等于2a | ||
D、若温度不变时将压强增大至原来的2倍,达到新平衡时,总体积一定比原体积的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测0.1mol/L 氨水的pH为11:NH3?H2O?NH4++OH- | ||||
| B、将Na块放入水中,放出气体:2Na+2H2O═2NaOH+H2↑ | ||||
C、用CuCl2 溶液做导电实验,灯泡发光:CuCl2
| ||||
| D、Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2 ↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 密度(g/mL) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 冰醋酸 | 1.049 | 16.6 | 118.1 | 能溶于水 |
| 异戊醇 | 0.812 | -117.2 | 130.5 | 微溶于水 |
| 乙酸异戊酯 | 0.869 | -78 | 140 | 难溶于水 |
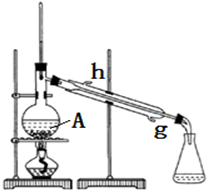
查看答案和解析>>
科目:高中化学 来源: 题型:
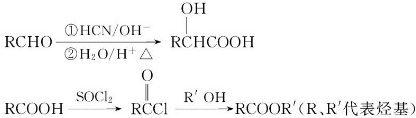
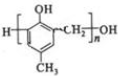 ,化合物C和化合物N的合成路线如下
,化合物C和化合物N的合成路线如下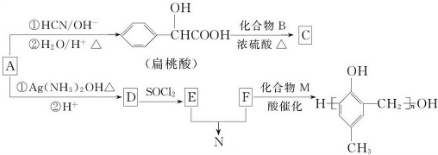
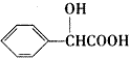 )有多种同分异构体.其中含有三个取代基,能与FeCl3溶液发生显色反应,也能与NaHCO3溶液反应放出气体的同分异构体共有
)有多种同分异构体.其中含有三个取代基,能与FeCl3溶液发生显色反应,也能与NaHCO3溶液反应放出气体的同分异构体共有查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com