
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$ 2Hg+O2 | B. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$ 3Fe+4CO2 | ||
| C. | Fe+CuSO4=Cu+FeSO4 | D. | 2NaCl(熔融)$\frac{\underline{\;高温\;}}{\;}$ 2Na+Cl2↑ |
科目:高中化学 来源: 题型:选择题

| A. | 若X为金属单质,则Y、Z可能为同一物质 | |
| B. | 若X为盐,则Y一定是CO2 | |
| C. | 若X为盐,则Z一定能使湿润的红色石蕊试纸变蓝 | |
| D. | 若X为盐,则其水溶液中水的电离程度比同温度下纯水的电离程度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
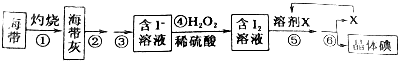

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中,有放热反应也有吸热反应 | |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| C. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应是吸热反应 | |
| D. | 化学反应中能量变化的大小与反应物的质量多少无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.
”相连的碳原子上的氢活性较大,可以与甲醛或卤代烃等发生反应.
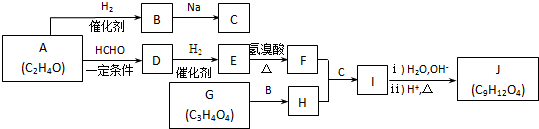
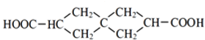 .J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.符合上述条件的X有2种,写出其中一种的结构简式
.J的同分异构体X属于芳香族化合物,1mol X分别与足量Na或NaOH反应时的物质的量之比是1:4和1:1,且苯环上只有一种一氯代物.符合上述条件的X有2种,写出其中一种的结构简式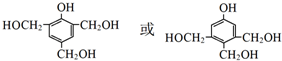 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .实验室制取并检验气体A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则是氨气.
.实验室制取并检验气体A的方法是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则是氨气.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com