
【题目】下列过程中化学键没有被破坏的是( )
A.水降温结冰
B.水电解得到氧气与氢气
C.NaCl晶体熔化
D.NaOH溶于水
科目:高中化学 来源: 题型:
【题目】铜元素位于元素周期表中第ⅠB族,在化合物中其化合价可以呈现+1、+2 价。铜的单质及其化合物在很多领域有重要的应用。
Ⅰ.CuSO4和Cu(NO3)2是常见的+2价铜的化合物,有较为广泛的应用。
(1)向CuSO4溶液中滴加氨水,最后可以得到深蓝色的[Cu(NH3)4]SO4溶液。
①N、O、S三种元素的第一电离能由大到小的顺序为______________________________。
②比较NH3 和[Cu(NH3)4]2+中H-N-H键角的大小:NH3___________[Cu(NH3)4]2+(填“>”或“<”),并说明理由________________________。
(2)制备Cu(NO3)2的一种方法是在N2O4的乙酸乙酯溶液中加入铜,反应一段时间后,加热即可得到Cu(NO3)2。
①NO3- 的立体构型的名称为_______________,N原子的杂化方式为________________。NO3- 的一种等电子体为________________________。
②N2O4会发生类似于水的自偶电离N2O4![]() NO++NO3- ,制备无水Cu(NO3)2的化学方程式为__________________________________________。
NO++NO3- ,制备无水Cu(NO3)2的化学方程式为__________________________________________。
Ⅱ.CuCl是较为常见的+1价铜的化合物。
(3)基态Cu+ 的价层电子排布式为________________________。
(4)CuCl的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
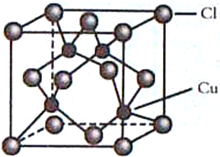
①每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
②设NA为阿伏加德罗常数的值,晶体的密度为ρg/cm3,CuCl的摩尔质量为M g/mol,计算晶胞中距离最近的两个Cu原子间的距离为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50.0mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后,得到沉淀14.51g,将沉淀用过量稀HNO3处理后,沉淀质量减少到4.66g,并有气体放出,试计算:
(1)原溶液中Na2SO4的物质的量为______________;
(2)生成气体的体积(标准状况)为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1是细胞中化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )

A. 若图1表示细胞鲜重,则A、B化合物依次是H2O、蛋白质
B. 若图2表示组成人体细胞的元素含量,则a、b、c依次是O、C、H
C. 地壳与活细胞中含量最多的元素都是a,因此说明生物界与非生物界具有统一性
D. 若图1表示细胞完全脱水后化合物的含量,则A化合物具有多样性,其中含的元素为C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F( )为一种高分子树脂,其合成路线如下:
)为一种高分子树脂,其合成路线如下:

已知:①A为苯甲醛的同系物,分子中无甲基,其相对分子质量为134;
②
请回答下列问题:
(1)X的化学名称是_________________。
(2)E生成F的反应类型为_________________。
(3)D的结构简式为_________________。
(4)由B生成C的化学方程式为_________________。
(5)芳香族化合物Y是D的同系物,Y的同分异构体能与饱和Na2CO3溶液反应放出气体,分子中只有1个侧链,核磁共振氢普显示有5种不同化学环境的氢,峰值面积比为6:2:2:1:1。写出两种符合要求的Y的结构简式___________、__________。
(6)写出以甲醛、丙醛和乙二醇为主要原料合成软质隐形眼镜高分子材料—聚甲基丙烯酸羟乙酯( )的合成路线(无机试剂自选):_________________。
)的合成路线(无机试剂自选):_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是生物体内四种有机物的组成与功能关系图,有关叙述错误的是

A. 小麦种子细胞中,物质A是葡萄糖,物质E是淀粉
B. 相同质量的E和F彻底氧化分解,释放能量较多的是F
C. 物质C的种类约有20种,基本组成元素是C、H、O、N
D. SARS病毒的物质H彻底水解后,产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】括号内物质为杂质,下列除去杂质的方法不正确的是( )
A.乙醇(水):先加生石灰后蒸馏
B.溴苯(溴):用NaOH溶液洗涤后分液
C.乙烷(乙烯):用溴水洗气
D.乙酸乙酯(乙酸):用NaOH溶液洗涤后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下:
![]()
①反应I为NO +O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是__________mol
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为___________
(2)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置I中发生反应的离子方程式为____________________________________

(3)装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式____________________________________
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的_____________(填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为_________________________________
(5)取少量装置Ⅳ所得的产品溶于水,溶液中离子浓度由大到小的顺序为_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 25℃时,物质的量浓度均为0.1mol/L的下列四种溶液:
① Na2CO3溶液 ② NaHCO3溶液 ③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是_________________________。
(2)清除水瓶水垢中含有的CaSO4的方法是:将水瓶中的水垢用碳酸钠饱和溶液浸泡后加水冲洗,再加入盐酸即可,请写出上述反应的化学方程式:________________、_____________ 。
(3)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验事实证明之____________________。
(4)电离平衡常数(用K表示)是一种平衡常数。电离平衡常数的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式 | HF | H2CO3 | HClO |
电离平衡常数(K) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
氢氟酸的电离方程式为____________________,次氯酸电离平衡常数的表达式为_______________。
(5)25℃时,pH=3的HF溶液中,未电离的氟化氢物质的量浓度为_______________________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com