

分析 A、B、C、D四种短周期主族元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D为Cl元素;组成单质E的元素是常见金属元素,位于元素周期表第4周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素.
(1)H2O2属于共价化合物;
(2)SO2通入H2O2溶液中可被氧化为W,则W为H2SO4,Fe、硫酸、石墨组成原电池,Fe发生氧化反应生成亚铁离子,作负极,石墨为正极,氢离子在正极获得电子生成氢气;
(3)甲中Fe与氯化铁反应生成氯化亚铁,乙中石墨、铁在氯化铁电解质溶液中形成原电池,石墨为正极,Fe3+在正极获得电子生成Fe2+,Fe为负极,发生氧化反应生成Fe2+,均发生反应:2Fe3++Fe=3Fe2+.
解答 解:A、B、C、D四种短周期主族元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D为Cl元素;组成单质E的元素是常见金属元素,位于元素周期表第4周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素.
(1)H2O2属于共价化合物,含有共价键,故答案为:共价键;
(2)SO2通入H2O2溶液中可被氧化为W,则W为H2SO4,Fe、硫酸、石墨组成原电池,Fe发生氧化反应生成亚铁离子,作负极,石墨为正极,氢离子在正极获得电子生成氢气,现象为:有气泡产生,故答案为:负;氧化;有气泡产生;
(3)甲中Fe与氯化铁反应生成氯化亚铁,乙中石墨、铁在氯化铁电解质溶液中形成原电池,石墨为正极,Fe3+在正极获得电子生成Fe2+,Fe为负极,发生氧化反应生成Fe2+,均发生反应:2Fe3++Fe=3Fe2+,二者共存现象为:铁棒变细,溶液由黄色逐渐变为浅绿色,故答案为:铁棒变细,溶液由黄色逐渐变为浅绿色.
点评 本题考查结构性质位置关系应用,侧重对原电池的考查,正确推断元素的种类为解答该题的关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
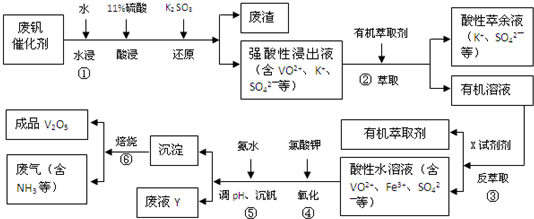
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,含有的化学键为极性键、非极性键(填“极性键”、“非极性键”、“离子键”).
,含有的化学键为极性键、非极性键(填“极性键”、“非极性键”、“离子键”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30mL 30mol•L-1 | B. | 25mL 2mol•L-1 | C. | 10mL 1mol•L-1 | D. | 18mL 4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能改变反应速率 | B. | 升高温度能加快反应速率 | ||
| C. | 降低压强能减小反应速率 | D. | 改变压强对反应速率没有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2,SiO2,Al2O3均为酸性氧化物 | B. | 稀豆浆,雾,氯化铁溶液均为胶体 | ||
| C. | 漂白粉,水玻璃,氨水均为混合物 | D. | 烧碱,冰醋酸,乙醇均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)为达到相关实验目的,有如下操作,但其中有的正确,有的却因用错试剂,或加入试剂的顺序错误等原因而导致实验失败.请用下列选项的字母代号填空.
(1)为达到相关实验目的,有如下操作,但其中有的正确,有的却因用错试剂,或加入试剂的顺序错误等原因而导致实验失败.请用下列选项的字母代号填空.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com