
分析 ①根据盖斯定律,物质具有的能量越低越稳定;
②键能越大越稳定,其能量也就越低.
解答 解:①C(s、金刚石)+O2═CO2(g)△H=-395.4kJ/mol,
C(s、石墨)+O2═CO2(g)△H=-393.5kJ/mol,由盖斯定律,C(s、金刚石)=C(s、石墨)△H=-1.9kJ/mol,由热化学方程式可知,金刚石所含能量高,能量越低越稳定,所以石墨比较稳定,故答案为:大于;
②△H=反应物键能-生成物键能,两反应中只要石墨和金刚石不同,从△H的值可分析出,石墨的键能大,故答案为:大于.
点评 本题考查了物质键能越大能量越低则其越稳定,热化学方程式的书写,注意注意物质的状态、△H的值与化学计量数的对应.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
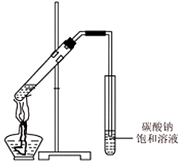 已知:乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
已知:乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.| 实验现象 | 结 论 | |
| ① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com