
根据盖斯定律计算:已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为C(金刚石,s)+O2(g)===CO2(g) ΔH1=-395.41 kJ·mol-1,C(石墨,s)+O2(g)===CO2(g)
ΔH2=-393.51 kJ·mol-1,则金刚石转化为石墨时的热化学方程式为
________________________________________________________________________
________________________________________________________________________。
由此看来更稳定的碳的同素异形体为__________。若取金刚石和石墨的混合晶体共1 mol在O2中完全燃烧,产生热量为Q kJ,则金刚石和石墨的物质的量之比为_____________
_________(用含Q的代数式表示)。
科目:高中化学 来源: 题型:
某气态化合物X含C、H、O三种元素,现已知下列条件:①X中C的质量分数;②X中H的质量分数;③X在标准状况下的体积;④X对氢气的相对密度;⑤X的质量,欲确定化合物X的分子式,所需的最少条件是 ( )
A.①②④ B.②③④ C.①③⑤ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物在工业上有广泛用途,以硅粉、镁粉等原料制备硅烷的工业流程如下:
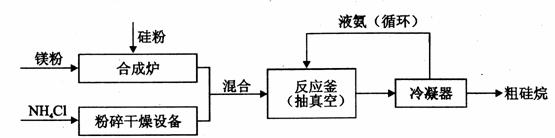
反应釜中发生反应:4NH4 Cl+Mg2 Si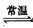 4NH3↑+SiH4↑+2MgCl2 △H<0
4NH3↑+SiH4↑+2MgCl2 △H<0
(1)工业上可用硅烷和氨气生产一种能耐高温的材料Si3 N4,Si3 N4应属于 晶体;NH3、Si3 N4和SiH4三种物质的熔沸点由高到低的顺序是 。
(2)上述生产硅烷的过程中反应釜抽真空的原因是 。
(3)液氨参与循环的作用是 。
(4)氨气也是重要的工业原料,1mol氨气在一定温度下(T>150℃)发生催化氧化反应能释放出226.5kJ的热量,该反应的热化学方程式是 。
(5)三硅酸镁( Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它可以中和多余胃酸(主要成分盐酸),生成的难溶物还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与胃酸反应的化学方程式是 。若将1.84g三硅酸镁加到50mL 1.0mol/L盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用l.0mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30mL,则Mg2Si3O8·nH2O中n的值是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为-285.8 kJ·mol-1、-282.5 kJ·mol-1、-726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇CO(g)+2H2(g)===CH3OH(l)。则CO与H2反应合成甲醇的热化学方程式为( )
A.CO(g)+2H2(g)===CH3OH(l) ΔH=-127.4 kJ·mol-1
B.CO(g)+2H2(g)===CH3OH(l) ΔH=127.4 kJ·mol-1
C.CO(g)+2H2(g)===CH3OH(g) ΔH=-127.4 kJ·mol-1
D.CO(g)+2H2(g)===CH3OH(g) ΔH=127.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:Ni2++2e-—→Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃时,将2个铜电极插入到一定的Na2SO4饱和溶液中,通直流电电解并不断搅拌,当阴极上收集到a mol气体时,溶液中析出了b mol的结晶水合物Na2SO4·10H2O,若保持温度不变,则所剩溶液中溶质的质量分数是( )
A.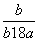 B.
B.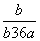 C.
C.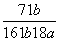 D.
D.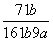
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示是一种牛奶的营养成分表。
 营养成分平均含量(每100 mL)
营养成分平均含量(每100 mL)
脂肪 1.3 g
蛋白质 3.6 g
糖类 5.7 g
钙 200 mg
非脂乳固体 9.5 g
配料:脱脂奶、鲜牛奶、稳定剂、碳酸钙
(1)计算该牛奶一盒(250 mL)中所含蛋白质的质量是多少?
(2)一个体重60 kg的成年人,每天需要补充70~105 g蛋白质,如果该成年人以该种牛奶来维持蛋白质的需求,每天需饮用这种牛奶的体积最少是多少?
(3)已知蛋白质、淀粉在体内氧化所释放的热量分别约占总热量的10%~15%、60%~70%,1 g蛋白质与1 g淀粉在体内氧化时大约均可产生16.7 kJ热能,试问该成年人每天至少摄取多少克淀粉方可满足生理需求,维持膳食平衡?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com