
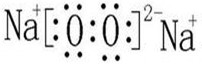 .
. 分析 (1)根据同一周期从左到右元素原子半径逐渐减小以及下一周期元素原子半径比上一周期大;
(2)先根据质量数=质子数+中子数,求出中子数,最后比较大小;
(3)根据O的化合价有:-1、-2、0;Na的化合价有:0、+1;Mg的化合价有:0、+2;N的化合价为:-3、0、+1、+2、+3、+4、+5来解答;
(4)根据X2Y2型化合物的是Na2O2,X3Y2型化合物的是Mg3N2来解答.
解答 解:(1)因同一周期从左到右元素原子半径逐渐减小,所以半径:2311Na>2412Mg,147N>188O; 下一周期元素原子半径比上一周期大,所以2311Na>2412Mg>147N>188O;
故答案为:③>②>④>①;
(2)188O的质子数为8,中子数为10,
2412Mg的质子数为12,中子数为12,
2311Na的质子数为11,中子数为12,
147N的质子数为7,中子数为7,
所以质子数小于中子数的是188O、2311Na;
故答案为:①③;
(3)O的化合价有:-1、-2、0;Na的化合价有:0、+1;Mg的化合价有:0、+2;N的化合价为:-3、0、+1、+2、+3、+4、+5,所以在化合物中呈现的化合价的数值最多的是N;
故答案为:④;
(4)O和Na可以形成Na2O2,电子式: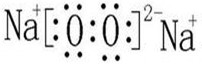 ;Mg和N能形成Mg3N2;
;Mg和N能形成Mg3N2;
故答案为:Mg3N2;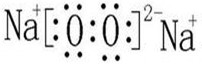 ;
;
点评 本题主要考查了原子半径大小比较、质量数=质子数+中子数,质子数=原子序数以及元素的最高化合价=最外层电子数等,难度不大,在问题(3)中需要注意的是O、F无正价.


科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:As>C1>P | B. | 热稳定性:HC1>AsH3>HBr | ||
| C. | 还原性:As3->S2->C1- | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述钛原子中,中子数不可能为22 | |
| B. | 钛元素在周期表中处于第四周期ⅡB族 | |
| C. | 钛原子的外围电子层排布为3d24s2 | |
| D. | 钛元素位于元素周期表的d区,是过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数Ka | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟利昂(CCl2F2)因破坏大气臭氧层,会导致“温室效应” | |
| B. | 生活污水中所含的氮、磷化合物是植物营养素,但会导致水体污染 | |
| C. | 废旧电池的回收,其主要目的是为了保护环境 | |
| D. | 淀粉餐具被认为是最有发展前景的一次性餐具,可有利于保护环境 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com