
| A. | 2d1 | B. | 3f7 | C. | 6s3 | D. | 7p2 |
科目:高中化学 来源: 题型:选择题
| A. | 0句 | B. | 1句 | C. | 2句 | D. | 3句 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时16O的相对原子质量为32 | |
| B. | 40gNaOH溶于水配成1L溶液,其物质的量浓度为1 mol/L | |
| C. | 标况下44gCO2的体积为22.4L | |
| D. | NA个氧分子与NA个氢分子有相同数目的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若降低温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 随着反应的进行,逆反应速率逐渐增大,最后不变 | |
| D. | 达到化学平衡状态时,SO2和SO3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
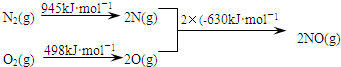
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离程度:①<② | |
| B. | ①、②中粒子浓度关系均符合:c(Na+)+c(H+)=c(OH+)+c(HCO2-)+c(CO32-) | |
| C. | 将③、④混合,所得溶液的pH>7,则该溶液中:c(NH4+)+c(NH3.H2O)<0.1mol.L-1 | |
| D. | 向③、④中分别加入25mL0.1mol.L-1盐酸后,溶液中c(NH4+):③<④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com