
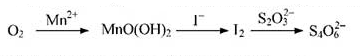
分析 (1)依据方程式可知反应时加入氢氧化钙是为了提高双氧水的利用率;
(2)过氧化钙与水反应生成氢氧化钙、氧气和水,因此箱池水塘中加入一定量的CaO2•8H2O,池塘水中浓度增加的离子有钙离子和氢氧根离子;
(3)①O2将Mn2+氧化成MnO(OH)2的反应中O2是氧化剂得到4个电子,Mn元素的化合价从+2价升高到+4价,失2个电子,所以根据电子得失守恒以及原子守恒可知反应的离子方程式为:O2+2Mn2++4OH-=MnO(OH)2;
②依据流程图并依据电子得失守恒可知氧气得到的电子就是硫代硫酸钠失去的电子,其中硫元素化合价从+2价升高到+2.5价,计算该水样中的溶解氧.
解答 解:(1)依据方程式Ca(OH)2+H2O2+6H2O═CaO2•8H2O可知,反应时加入氢氧化钙是为了提高双氧水的利用率,
故答案为:提高过氧化氢的利用率;
(2)过氧化钙与水反应生成氢氧化钙、氧气和水,因此箱池水塘中加入一定量的CaO2•8H2O,池塘水中浓度增加的离子有钙离子和氢氧根离子,选择AD,
故答案为:AD;
(3)①O2将Mn2+氧化成MnO(OH)2的反应中O2是氧化剂得到4个电子,Mn元素的化合价从+2价升高到+4价,失2个电子,所以根据电子得失守恒以及原子守恒可知反应的离子方程式为:O2+2Mn2++4OH-=2MnO(OH)2,
故答案为:O2+2Mn2++4OH-=2MnO(OH)2;
②I2+2S2O32-=2I-+S4O62-,n(I2)=$\frac{c(N{a}_{2}{S}_{2}{O}_{3})V(N{a}_{2}{S}_{2}{O}_{3})}{2}$=$\frac{0.01000mol/L×13.50ml×1{0}^{-3}L/mol}{2}$=6.750×10-5mol,
n(MnO(OH)2)=n(I2)=6.750×10-5mol,
n(O2)=$\frac{1}{2}$n(MnO(OH)2)=$\frac{1}{2}$×6.750×10-5mol=3.375×10-5mol,
水中溶解氧=$\frac{3.375×1{0}^{-5}mol×32g/mol×1000mg/g}{100ml×1{0}^{-3}l/ml}$=10.80mg/L,
答:该水样中的溶解氧10.80mg/L.
点评 本题考查氧化还原反应方程式书写以及溶解氧含量测定等,主要是滴定实验过程的理解应用和计算分析,掌握基础是解题关键,题目难度中等.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=10的NaOH溶液和pH=4的盐酸溶液中,水的电离程度 | |
| B. | 将pH=3的盐酸和醋酸分别稀释成pH=5的溶液,需加水的体积 | |
| C. | 10mL0.1mol•L-1的醋酸与100mL0.01mol•L-1的醋酸中的H+物质的量 | |
| D. | 等体积pH相等的醋酸和盐酸,分别与过量的锌粉反应产生的H2的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镍基含铼单晶合金属于混合物 | |
| B. | ${\;}_{75}^{185}$Re和${\;}_{75}^{187}$Re互称为核素 | |
| C. | 铼(Re)元素的相对原子质量为186 | |
| D. | 含铼合金比纯铼的熔点高、硬度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(OH-)>c(HCO3-)>c(CO32-) | B. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | D. | c(Na+)>c(OH-)>c(CO32-)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜插入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+3H+═H2SiO3↓+3Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 12.2 | 3.2 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2CO3溶液中加过量NaOH溶液并加热:NH4++OH-=NH3•H2O | |
| B. | 金属铝溶于氢氧化钠溶液Al+2OH-=AlO2-+H2↑ | |
| C. | 用烧碱溶液吸收氯气:Cl2+OH-=Cl-+ClO-+H2O | |
| D. | 碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH-═H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2和Na2S混合物中含有的阴离子数目为0.1NA | |
| B. | pH=13的氢氧化钾溶液,含K+数目约为0.1NA | |
| C. | 标准状况下,5.6LO2作为氧化剂时转移的电子数一定为NA | |
| D. | 18gD2O所含电子数目为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com