
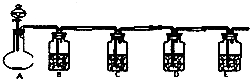
 设计一实验将只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来.取一定量的白色固体与烧瓶A中,通过分液漏斗加入液体a,如图所示:
设计一实验将只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来.取一定量的白色固体与烧瓶A中,通过分液漏斗加入液体a,如图所示:分析 (1)三种成分检验出来需要利用亚硫酸钠、碳酸钠和酸反应生成二氧化硫、二氧化碳进行检验,有气体生成的反应,所以实验开始前,需进行的操作是检查装置的气密性;
(2)三种成分检验出来需要利用亚硫酸钠、碳酸钠和酸反应生成二氧化硫、二氧化碳进行检验,装置A中发生的反应是亚硫酸钠、碳酸钠和硫酸发生反应生成二氧化硫、二氧化碳;
(3)分液漏斗中液体应是硫酸溶液,二氧化硫和二氧化碳检验需要先利用装置B中品红溶液检验二氧化硫存在,利用装置C中高锰酸钾溶液除去二氧化硫,通过D中品红溶液检验二氧化硫是否除净;
(4)检验出Na2CO3的现象是利用D中品红不褪色,E中澄清石灰水变浑浊说明生成了二氧化碳;
(5)装置C中的试剂还可用与KMnO4具有相同反应原理是利用氧化还原反应把二氧化硫氧化为硫酸,选择的物质需要具有氧化性,溶液颜色变化明显,且不具有挥发性的试剂可以是铁盐溶液;
(6)在检验Na2SO3、Na2CO3的实验时已经向烧瓶中加入了硫酸,反应后烧瓶A中的液体中含有加入的硫酸,不能检验硫酸钠的存在;
解答 解:(1)只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来需要利用亚硫酸钠、碳酸钠和酸反应生成二氧化硫、二氧化碳进行检验,所以实验开始前,需进行的操作是检查装置的气密性,
故答案为:检查装置气密性;
(2)三种成分检验出来需要利用亚硫酸钠、碳酸钠和酸反应生成二氧化硫、二氧化碳进行检验,装置A中发生的反应是亚硫酸钠、碳酸钠和硫酸发生反应生成二氧化硫、二氧化碳;,反应的离子方程式为:CO32-+2H+=CO2↑+H2O,SO32-+2H+=SO2↑+H2O,
故答案为:CO32-+2H+=CO2↑+H2O,SO32-+2H+=SO2↑+H2O;
(3)分液漏斗中液体应是硫酸溶液,二氧化硫和二氧化碳检验需要先利用装置B中品红溶液检验二氧化硫存在,利用装置C中高锰酸钾溶液除去二氧化硫,通过D中品红溶液检验二氧化硫是否除净,已知B、D都为品红,C为酸性KMnO4溶液,则D装置的作用为检验二氧化硫是否除净,
故答案为:检验二氧化硫是否除净;
(4)检验出Na2CO3的现象是检验二氧化碳气体的生成,二氧化硫也会和澄清石灰水反应生成沉淀,溶液变浑浊,所以需要先除去二氧化硫,利用D中品红不褪色,E中澄清石灰水变浑浊说明生成了二氧化碳证明碳酸钠的存在,
故答案为:D中品红不褪色,E中石灰水变浑浊;
(5)装置C中的试剂还可用与KMnO4具有相同反应原理是利用氧化还原反应把二氧化硫氧化为硫酸,选择的物质需要具有氧化性,溶液颜色变化明显,且不具有挥发性的试剂可以是铁盐溶液,反应的离子方程式为:2Fe3++SO2+2H2O=SO42-+2Fe2++4H+,
故答案为:2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;
(6)在检验Na2SO3、Na2CO3的实验时已经向烧瓶中加入了硫酸,反应后烧瓶A中的液体中含有加入的硫酸,不能检验硫酸钠的存在,不能直接用反应后烧瓶A中的液体检验Na2SO4,
故答案为:不能,因为在检验Na2SO3、Na2CO3的实验时已经向烧瓶中加入了硫酸,直接用反应后烧瓶中的溶液就不能说明原固体中含有Na2SO4;
点评 本题考查了物质组成、物质性质、物质检验的实验设计方法等,注意二氧化硫、二氧化碳气体的检验方法、检验顺序和实验干扰分析判断,试剂选择是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 使酚酞呈红色的溶液:Na+、NO3-、Ba2+、Br- | |
| B. | 加水稀释pH减小的溶液:K+、Al3+、Cl-、CH3COO- | |
| C. | 含有大量Fe(NO3)2的溶液:NH4+、H+、SO42-、I- | |
| D. | c(OH-)<$\sqrt{{K}_{w}}$的溶液:ClO-、NO3-、Na+、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
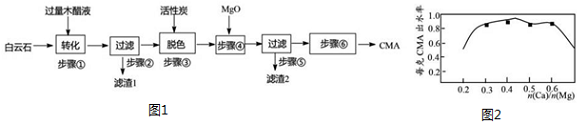
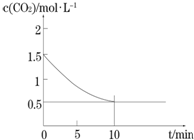 一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.
一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g) | 54.6 | 0.000 84 | 0.039 |
| A. | 已知MgCO3的Ksp=2.14×10-5 mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=2.14×10-5mol2•L-2 | |
| B. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 | |
| C. | 将适量的表中的三种物质分别与足量水混合,充分加热、灼烧,最终的固体产物相同 | |
| D. | 用石灰水处理水中的Mg2+和HCO3-,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| Z | 第三周期原子半径最小的金属元素 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 离子半径:Z>W | |
| D. | Z 的氧化物不具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1氨水中有NA个NH4+ | |
| B. | 常温常压下,22.4 L CO2中含有NA个CO2分子 | |
| C. | 1L 0.1mol•L-1Na2SO3溶液中含有 0.1NA个SO32- | |
| D. | 1L 0.1mol•L-1AlCl3溶液中含有氯离子数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com