
|
在25℃ 101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是 | |
A. |
CH3OH(l)+3/2O2(g) |
B. |
2CH3OH(l)+3O2(g) |
C. |
2CH3OH(l)+3O2(g) |
D. |
2CH3OH(l)+3O2(g) |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:北京市师大附中2011-2012学年高二下学期期中考试化学试题 题型:022
煤的气化是高效、清洁地利用煤炭的重要途径之一.
(1)在25℃、101 kPa时,H2与O2化合生成1 mol H2O(g)放出241.8 kJ的热量,其热化学方程式为________.
又知:①C(s)+O2(g)=CO2(g); ΔH=-393.5 kJ/mol
②CO(g)+1/2 O2(g)=CO2(g); ΔH=-283.0 kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)=CO(g)+H2(g);ΔH=________kJ/mol.
(2)CO可以与H2O(g)进一步发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH<0在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0.
CO2(g)+H2(g);ΔH<0在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0.
①该反应的平衡常数表达式为________.
②平衡时,甲容器中CO的转化率是________;
容器中CO的转化率;乙________甲;丙________甲.(填“>”、“=”或“<”)
③丙容器中,通过改变温度,使CO的平衡转化率升高,则温度________(填“升高”或“降低”).
查看答案和解析>>
科目:高中化学 来源:江苏省扬州中学2012届高三3月双周练习(一)化学试题 题型:013
|
NA为阿伏加德罗常数,下列各项叙述中正确的有 ①0.2 mol H2O2完全分解转移的电子数为0.4NA ②25℃、101 k Pa下,16 g O3和O2混合气体中含有的氧原子数为NA ③0.1 mol FeCl3滴入沸水形成的胶体粒子的数目为0.1NA ④1 mol N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2NA | |
| [ ] | |
A. |
①②③ |
B. |
①②④ |
C. |
①②③④ |
D. |
②④ |
查看答案和解析>>
科目:高中化学 来源:北京市海淀区2011届高三二模理综化学试题 题型:022
煤的气化是高效、清洁地利用煤炭的重要途径之一.
(1)
在25℃、101 kPa时,H2与O2化合生成1 mol H2O(g)放出241.8 kJ的热量,其热化学方程式为________.又知:①C(s)+O2(g) CO2(g) ΔH=-393.5 kJ/mol
CO2(g) ΔH=-393.5 kJ/mol
②CO(g)+![]() O2(g)
O2(g) CO2(g) ΔH=-283
CO2(g) ΔH=-283
焦炭与水蒸气反应是将固体煤变为气体燃料的方法
,C(s)+H2O(g) CO(g)+H2(g) ΔH=________kJ/mol.
CO(g)+H2(g) ΔH=________kJ/mol.
(2)CO
可以与H2O(g)进一步发生反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0.

①该反应的平衡常数表达式为________.
②平衡时,甲容器中CO的转化率是________;
容器中CO的转化率:乙________甲;丙________甲.(填“>”、“=”或“<”)
③丙容器中,通过改变温度,使CO的平衡转化率升高,则温度________(填“升高”或“降低”).
查看答案和解析>>
科目:高中化学 来源:山东省莱州一中2012届高三第二次质量检测化学试题 题型:058
“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率.
已知25℃,101 kPa时:C(s)+1/2O2(g)=CO(g);ΔH=-126 kJ·mol-1
2H2(g)+O2(g)=2H2O(1);ΔH=-571.6 kJ·mol-1;H2O(g)=H2O(1);ΔH=-44 kJ·mol-1
则在25℃,101 kPa时:C(s)+H2O(g)=CO(g)+H2(g);ΔH=________.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)![]() Fe(s)+CO2(g);ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263.
Fe(s)+CO2(g);ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263.
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值________(填“增大”、“减小”或“不变”);
②1100℃时测得高炉时,c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,在这种情况下,该反应是否处于化学平衡状态?________(填“是”或“否”),其判断依据是________.
③目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);ΔH=-49.0 kJΔmol-1.现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH2OH(g)的浓度随时间的变化如图所示.
CH3OH(g)+H2O(g);ΔH=-49.0 kJΔmol-1.现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH2OH(g)的浓度随时间的变化如图所示.
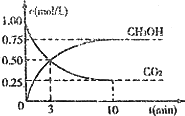
①从反应开始到平衡,氢气的平均反应速率v(H2)=________;
②下列措施能使![]() 增大的是________(填符号).
增大的是________(填符号).
A.升高温度
B.再充入H2
C.再充入CO2
D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
A.C8H18(l)+![]() O2(g)
O2(g)![]() 8CO2(g)+9H2O(g) ΔH(298 K)=-48.40 kJ·mol-1?
8CO2(g)+9H2O(g) ΔH(298 K)=-48.40 kJ·mol-1?
B.C8H18(l)+![]() O2(g)
O2(g)![]() 8CO2(g)+9H2O(l) ΔH(298 K)=-5 518 kJ·mol-1?
8CO2(g)+9H2O(l) ΔH(298 K)=-5 518 kJ·mol-1?
C.C8H18(l)+![]() O2(g)
O2(g)![]() 8CO2(g)+9H2O(l) ΔH(298 K)=+5 518 kJ·mol-1?
8CO2(g)+9H2O(l) ΔH(298 K)=+5 518 kJ·mol-1?
D.C8H18(l)+![]() O2(g)
O2(g)![]() 8CO2(g)+9H2O(l) ΔH(298 K)=-48.40 kJ·mol-1
8CO2(g)+9H2O(l) ΔH(298 K)=-48.40 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com